松島 綱治まつしま こうじ
細胞免疫学
研究テーマ
- 慢性炎症に伴う臓器線維化の分子・細胞基盤の解明とその制御
- がんに対する新規複合免疫療法の臨床開発
- 細胞・臓器移植に伴う慢性拒絶機序の解明とその解除
経歴
昭和53年に金沢大学医学部を卒業後、金沢大学大学院医学研究科に進学。昭和57年同研究科を修了し医学博士(分子免疫学)を取得後、米国NIHのDr. J OppenheimのもとでVisiting Fellow, Visiting Associate, Visiting Scientistとして活躍。平成元年にNIHでTenure(永久職)を取得するも、平成2年に金沢大学がん研究所薬理部教授として帰国。平成8年から東京大学医学部・大学院医学系研究科・分子予防医学教室の教授を務めた。平成30年4月に東京理科大学生命医科学研究所・炎症・免疫難病制御部門の教授として移動し現在に至る。
炎症・免疫難病制御部門は、炎症・免疫応答を時間軸、空間軸を含めた4次元の生体反応として理解し、疾患進展の鍵となる制御分子を同定することで、現在治療・予防法のない線維症などの慢性炎症性疾患に対する新規分子標的療法やがんに対する複合免疫療法の開発を目指しています。 炎症・免疫反応は内的・外的ストレスに対する生体防御応答ですが、炎症が持続または繰り返すことで、細胞・組織に機能障害を伴う異常な適応状態が定着し、最終的に線維化などにより臓器の機能が失われます。このような疾患進展の仕組みを明らかにし、新たな予防・治療法を開発するため、私たちは1細胞遺伝子発現解技術などにより炎症組織を構成する個々の組織常在細胞と浸潤免疫細胞の性質や役割、細胞間相互作用の解明に取り組んでいます。また、近年がん治療の主役になりつつあるがん免疫療法について、新たな複合免疫療法の開発に向けた基礎研究を行うとともに、がん研究センターとの共同研究で抗CD4抗体などの新たな治療薬の臨床治験を進めています。
慢性炎症に伴う臓器線維化の分子・細胞基盤の解明とその制御
肺線維症や肝硬変、腎硬化症などの臓器線維症は、何らかの原因で傷害を受けた組織が再生する過程で、組織にI型コラーゲンなどが過剰に沈着して硬くなり臓器の機能が失われる、慢性炎症に共通する終末像です。臓器線維化は先進国における死因の約3割に関わるといわれているほど患者数が多いにも関わらず、線維化が慢性的に進行する仕組みは不明な点が多く、効果的な予防・治療法は存在していません。私たちはこれまでに、次世代DNAシークエンサーによる遺伝子発現解析と、得られた膨大なデータから細胞が活性化する仕組みを探るネットワーク解析を用いて、I型コラーゲンの主な産生細胞である線維芽細胞が活性化する仕組みを解析し、臓器線維症の新たな治療標的を明らかにして来ました。最近では、新たに開発した1細胞遺伝子発現技術と情報処理技術を用いて、疾患の早期、進行期、慢性期の組織を構成する活性化状態の異なる様々な細胞同士の相互作用をシミュレートし、臓器線維化のカギとなる細胞や分子の同定を進めています。
がんに対する新規複合免疫療法の臨床開発
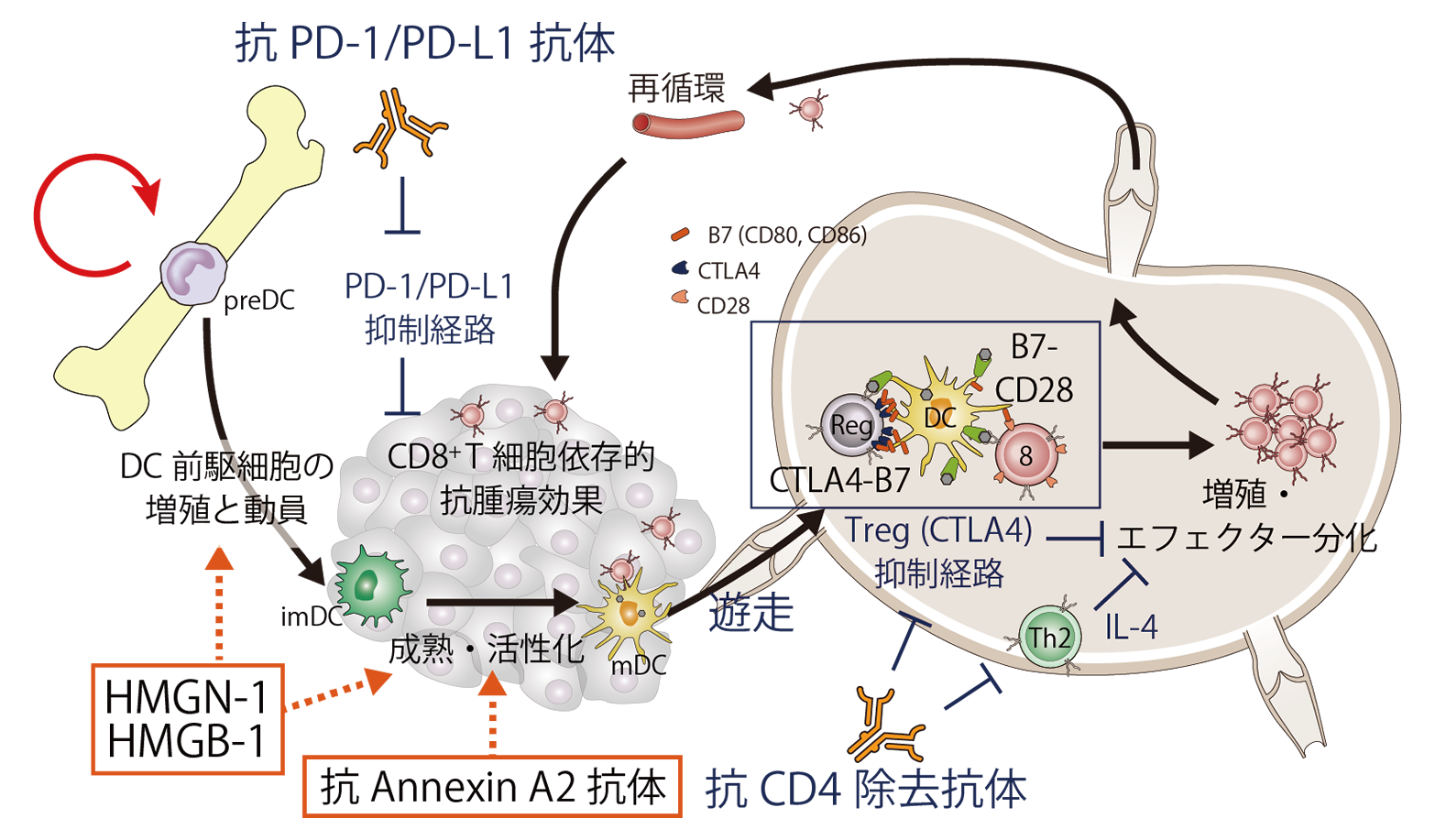
近年、CTLA-4やPD-1などの免疫応答を抑制するImmune-Checkpoint分子に対する中和抗体ががん治療に大きなインパクトを与えました。私たちは、マウス皮下腫瘍モデルでは、坑CD4除去抗体により制御性T細胞を含むCD4+ 細胞全体を広範かつ完全に除去することで、Immune-Checkpoint抗体を上回る強い腫瘍特異的CD8+ T細胞応答の活性化や抗腫瘍効果がえられることを明らかにしました。また、坑CD4抗体と抗PD-1/PDL-1抗体との併用は劇的な相乗効果をもたらし、一部の腫瘍モデルでは完全退縮と免疫メモリーを確立しました(Ueha et al. Cancer Immunol Res. 2015)。私達は2018年現在、進行・再発固形がん患者を対象として強力な除去活性を持つヒト型化抗CD4抗体IT1208の第I相医師主導臨床治験を進めています。さらに、より強力な複合免疫療法の開発や免疫治療戦略の最適化に必要な細胞動態の解明を目指した基礎研究をすすめるとともに、特異的な免疫応答を高感度に検出するために独自のTCRレパトア解析手法を開発し、免疫治療前後でのレパトア応答解析を進めています。
細胞・臓器移植に伴う慢性拒絶機序の解明とその解除
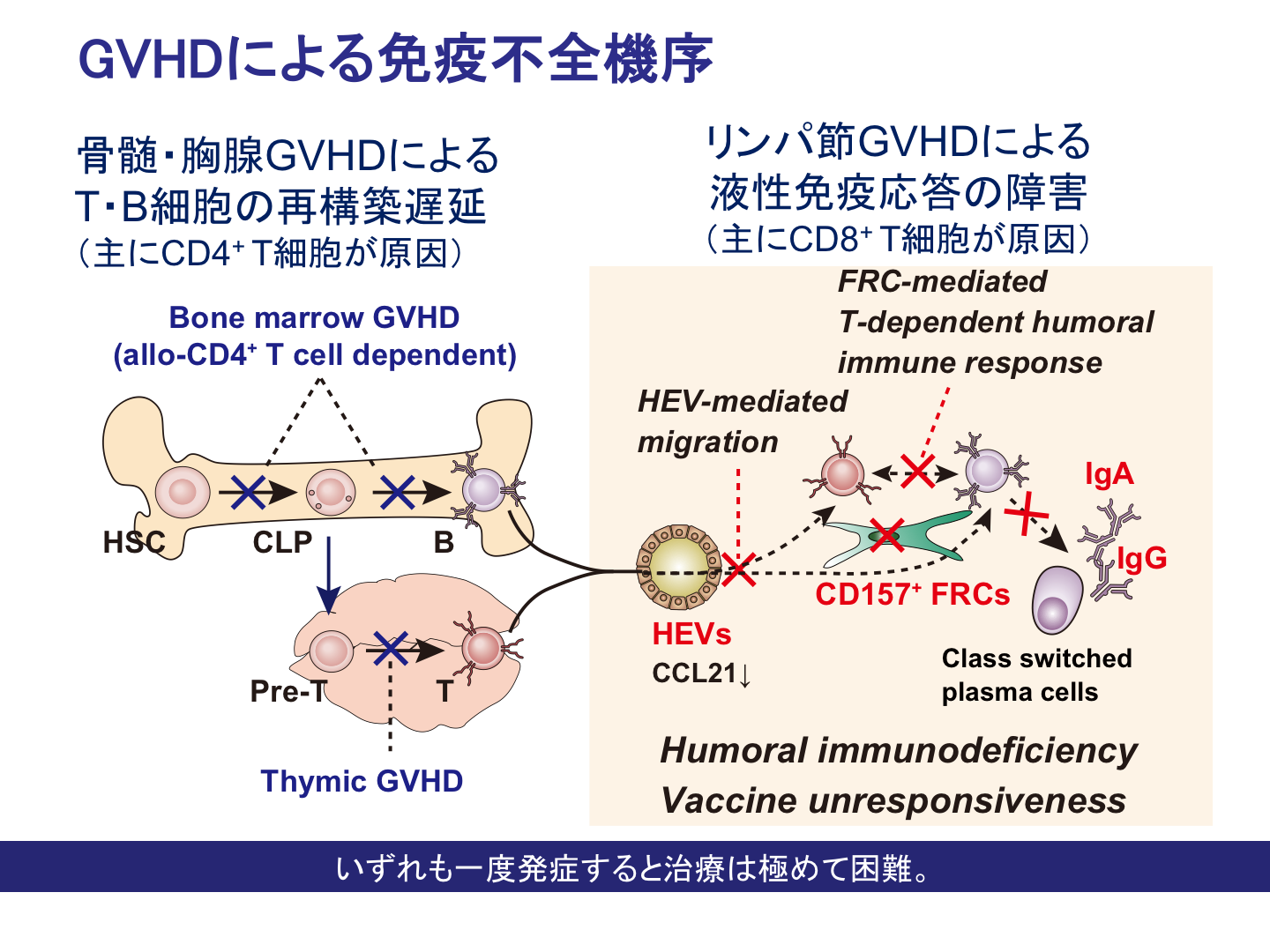
白血病などの治療として行われる同種造血幹細胞移植は、最も有効性が確立した免疫細胞治療法の一つですが、ドナーT細胞が異なる組織適合抗原を持つホストの細胞を異物として認識して排除応答を起こした結果発症する移植片対宿主病(GVHD)は、患者の生存予後に大きな影響を与えます。私達は、GVHD患者で頻発する免疫不全の発症機序を解析し、ドナーCD4+ T細胞が骨髄間葉系造血ニッチ細胞を障害することで、造血幹細胞からのリンパ球分化が抑制され、全身性に成熟T細胞、B細胞の再構築が阻害されること(Shono et al. Blood 2010)、ドナーCD8+ T細胞がリンパ節線維芽細胞・高内皮細静脈細胞を不可逆的に障害することで重篤な液性免疫不全に陥ること(Suenaga et al. J Immunol 2014)を明らかにしてきた。最近では、慢性GVHDをもたらすドナー T 細胞の誘導・維持機構を解析し、造血幹細胞とともに移植された成熟T細胞(graft-T)が100日以上残存しており、造血幹細胞からの新規T細胞(hsc-T)産生を阻害していること、一方hsc-Tはgraft-Tの過剰な活性化を抑制していること、すなわちgraft-Tとhsc-Tがお互いを抑制し合いながら慢性GVHDの病態形成に関与していることを明らかにしました(Kosugi et al. Front. Immunol. 2017)。また、同種造血幹細胞移植と坑CD4除去抗体の併用による安全かつ強力な固形がんに対する免疫細胞治療の可能性も検討しています(Shono et al, Blood 2010, Ueha et al. Cancer Sci. 2017)。
代表的な業績
- Sekido, N. et al. Prevention of lung reperfusion injury in rabbits by a monoclonal antibody against interleukin-8. Nature (1993). doi:10.1038/365654a0
- Wada, T. et al. Intervention of crescentic glomerulonephritis by antibodies to monocyte chemotactic and activating factor (MCAF/MCP-1). FASEB J. (1996).
- Yoneyama, H. et al. Pivotal Role of Dendritic Cell–derived CXCL10 in the Retention of T Helper Cell 1 Lymphocytes in Secondary Lymph Nodes. J. Exp. Med. (2002). doi:10.1084/jem.20011983
- Murai, M. et al. Peyer’s patch is the essential site in initiating murine acute and lethal graft-versus-host reaction. Nat. Immunol. (2003). doi:10.1038/ni879
- Hashimoto, S. I. et al. 5′-end SAGE for the analysis of transcriptional start sites. Nat. Biotechnol. (2004). doi:10.1038/nbt998
- Terashima, Y. et al. Pivotal function for cytoplasmic protein FROUNT in CCR2-mediated monocyte chemotaxis. Nat. Immunol. (2005). doi:10.1038/ni1222
- Sawanobori, Y. et al. Chemokine-mediated rapid turnover of myeloid-derived suppressor cells in tumor-bearing mice. Blood (2008). doi:10.1182/blood-2008-01-136895
- Yamamoto, K. et al. Phase I study of KW-0761, a defucosylated humanized anti-CCR4 antibody, in relapsed patients with adult T-cell leukemia-lymphoma and peripheral T-cell lymphoma. J. Clin. Oncol. (2010). doi:10.1200/JCO.2009.25.3575
- Shono, Y. et al. Bone marrow graft-versus-host disease: Early destruction of hematopoietic niche after MHC-mismatched hematopoietic stem cell transplantation. Blood (2010). doi:10.1182/blood-2009-11-253559
- Kurachi, M. et al. Chemokine receptor CXCR3 facilitates CD8 + T cell differentiation into short-lived effector cells leading to memory degeneration. J. Exp. Med. (2011). doi:10.1084/jem.20102101
- Tsukui, T. et al. Qualitative rather than quantitative changes are hallmarks of fibroblasts in bleomycin-induced pulmonary fibrosis. Am. J. Pathol. (2013). doi:10.1016/j.ajpath.2013.06.005
- Ueha, S. et al. Robust anti-tumor effects of combined anti-CD4 depleting antibody and anti-PD-1/PD-L1 immune checkpoint antibody treatment in mice. Cancer Immunol. Res. (2015). doi:10.1158/2326-6066.CIR-14-0190
- Shichino, S. et al. Reduced supply of monocyte-derived macrophages leads to a transition from nodular to diffuse lesions and tissue cell activation in silica-induced pulmonary fibrosis in mice. Am. J. Pathol. (2015). doi:10.1016/j.ajpath.2015.07.013
- Tsukui, T., Ueha, S., Shichino, S., Inagaki, Y. & Matsushima, K. Intratracheal cell transfer demonstrates the profibrotic potential of resident fibroblasts in pulmonary fibrosis. Am. J. Pathol. (2015). doi:10.1016/j.ajpath.2015.07.022
- Hashimoto, S. et al. Comprehensive single-cell transcriptome analysis reveals heterogeneity in endometrioid adenocarcinoma tissues. Sci. Rep. (2017). doi:10.1038/s41598-017-14676-3
- Chen CY, Ueha S, Ishiwata Y, Yokochi S, Yang D, Oppenheim JJ, Ogiwara H, Shichino S, Deshimaru S, Shand FH, Shibayama S, Matsushima K. Combined treatment with HMGN1 and anti-CD4 depleting antibody reverses T cell exhaustion and exerts robust anti-tumor effects in mice. J Immunother Cancer. 7(1):21, 2019.
- Aoki H, Ueha S, Shichino S, Ogiwara H, Hashimoto S, Kakimi K, Ito S, Matsushima K. TCR repertoire analysis reveals mobilization of novel CD8+ T cell clones into the Cancer-Immunity Cycle following anti-CD4 antibody administration. Front Immunol. 9:3185, 2019.
- Shichino S, Ueha S, Hashimoto S, Otsuji M, Abe J, Tsukui T, Deshimaru S, Nakajima T, Kosugi-Kanaya M, Shand FH, Inagaki Y, Shimano H, Matsushima K. Transcriptome network analysis identifies protective role of the LXR-SREBP-1c axis in murine pulmonary fibrosis. JCI Insight. 4(1):122163,2019.
- Shitara K, Ueha S, Shichino S, Aoki H, Ogiwara H, Nakatsura T, Suzuki T, Shimomura M, Yoshikawa T, Shoda K, Kitano S, Yamashita M, Nakayama T, Sato A, Kuroda S, Wakabayashi M, Nomura S, Yokochi S, Ito S, Matsushima K, Doi T. First-in-human phase 1 study of IT1208, a defucosylated humanized anti-CD4 depleting antibody, in patients with advanced solid tumors. J Immunother Cancer. 7(1):195, 2019.
- Terashima Y, Toda E, Itakura M, Otsuji M, Yoshinaga S, Kazuhiro Okumura K, Shand FH, Komohara Y, Takeda M, Kokubo K, Chen MC, Yokoi S, Rokutan H, Kofuku Y, Ohnishi K, Ohira M, Iizasa T, Nakano H, Okabe T, Kojima H, Shimizu A, Kanegasaki S, Zhang MR, Shimada I, Nagase H, Terasawa H, Matsushima K. Targeting FROUNT with disulfiram suppresses macrophage accumulation and tumor-promoting properties. Nat Commun. 11:609, 2020.

