北村 大介きたむら だいすけ
分子免疫学
研究テーマ
- B細胞の抗原認識および活性化のメカニズム
- 記憶細胞や抗体産生細胞の分化・制御機構
- B細胞がアレルギーを引き起こすメカニズムの解明
- in vitroにおける抗原特異的B細胞の選択と抗体の作製方法の開発
- B細胞を用いた癌のオーダーメイド治療法の開発
経歴
1984年佐賀医科大学(現佐賀大)医学部卒。1988年同大学院修了、医学博士修得(渡邊武教授)。同年九州大学生体防御医学研究所助手を経てドイツ・ケルン大学遺伝学研究所(Prof.Klaus Rajewsky)に留学。1991年九州大学生体防御医学研究所助手に復職。1994年同助教授。1995年本学生命科学研究所分子生物学研究部門教授。現在、薬学部教授を兼担。
B細胞およびT細胞の分化は抗原受容体遺伝子の再構成を伴い、それにより膨大な種類の抗原に対応できる極めて多様なレパートアが形成される。その過程で自己抗原に反応するクローンは淘汰される(自己寛容)。さらにB細胞では抗原との遭遇により抗原受容体(B-cell receptor; BCR)遺伝子の体細胞超変異およびクラススイッチが起こり、それによりBCRの特異性がさらに多様化し、機能は分化する。すなわち、抗原と結合した複数のB細胞クローンが増殖・多様化し、その中から抗原に対する親和性の高いクローンが選択され、増殖し形質細胞に分化して、抗体を産生する。また一部は記憶B細胞となる。このように、B細胞はクローンの増大、多様化、選択というプロセスを繰り返して、個体の防衛システムを構築し進化させていく。私たちは、このB細胞集団のダイナミックな進化と適応を破綻なく制御する仕組みを解明するために研究を行っている。
誘導性胚中心B細胞培養系を用いたB細胞後期分化誘導機構の研究
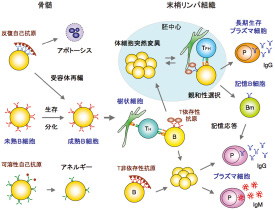
細胞依存性免疫応答の際、脾臓やリンパ節では抗原特異的なB細胞がT細胞ヘルプを受けて著しく増殖し胚中心(germinal center, GC)を形成する。胚中心では免疫グロブリン遺伝子に体細胞超変異が導入され、再びB細胞の抗原特異性が多様化する。その中から抗原に親和性の高いクローンが選択され記憶B細胞や長期生存プラズマ細胞に分化するが、この選択や分化の機構はほとんど分かっていない。これを解明するために、私たちは誘導性胚中心B (induced germinal center B: iGB) 細胞培養系を樹立し、研究を進めている。iGB細胞培養系とは、CD40L・BAFFを導入した繊維芽細胞(40LB)をフィーダーとして、ナイーブB細胞をまずIL-4存在下で3〜5日間、次にIL-21存在下で3〜5日培養する方法で、この培養法ではIgG1かIgEへクラススイッチしたGC B細胞の表現型(Fas+ GL7+ PNA+)を示すB細胞(iGB細胞)が最終的に10000倍以上に増殖する。IL-4で培養したiGB細胞(iGB-4)をマウスにi.v.により移入すると記憶B細胞の表現型と機能を有する細胞(induced memory B: iMB細胞)に分化し、末梢リンパ組織に長期生存する。また、IL-21で2次培養したiGB細胞(iGB-21)をマウスに移入するとiMB細胞は検出されず、代わりに骨髄にプラズマ細胞が検出される。その後、サイトカインを加えずに培養したiGB細胞(iGB-m)をマウスに移入するとiMB細胞が形成される。また、iGB-4およびiGB-m細胞からは骨髄プラズマ細胞は産生されない(野嶋ら 2011)。この培養系を用いて、現在は記憶B細胞への分化や維持に必要な因子、またプラズマ細胞分化を制御する因子を探索している。
In vitro抗原特異的B細胞選択系
上述のiGB細胞培養系を用いて任意の抗原に特異的なB細胞をin vitroで選択的に増殖させるシステムを構築している。まず、モデル抗原として膜結合型hen egg lysozyme (mHEL)を発現させた40LB細胞(40LB-mHEL)と、加えてFasLを発現させた40LB-mHEL-FLを作製した。HEL特異的Igノックインマウス(Hy10)のB細胞をわずかに含むiGB細胞を、これらのフィーダー上で順次培養した後、40LB上で回復増殖させると、HEL結合細胞を高度に濃縮させることができた。さらに、同様の培養方法で、通常のC57BL/6マウスのB細胞からHEL結合細胞を約15%にまで濃縮することができた。また、ヒト末梢血B細胞を用いた同様のiGB細胞培養系を確立しているが、現在、このヒトiGB細胞の抗原特異的B細胞選択系の構築を進めている。 このような方法で、例えば癌抗原特異的なiGB細胞を選択し、そこから抗体遺伝子を単離し、癌抗原特異的な完全ヒトモノクローナル抗体を作成することが可能になると思われる。また、癌患者の末梢血から同様に選択した癌抗原特異的なiGB-21細胞をその患者に戻せば、その細胞は長期生存プラズマ細胞となり、癌抗原特異的抗体を持続的に産生すると考えられる。マウスを用いたモデル実験では、Hy10マウス由来のiGB-21細胞の移入により、HEL抗原を発現するメラノーマ細胞の肺転移をほぼ完璧に抑制することができた。
BCRシグナル伝達を司るアダプターBLNK
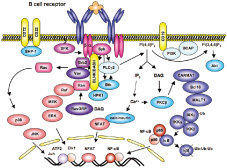
以前に私達はBCRシグナル伝達に関わるアダプター蛋白質を同定し、BASHと名付けた(後飯塚ら1998)。同じ分子が同時期に他の研究者からも報告され、BLNKあるいはSLP65と名付けられた。以来この分子は主にBLNKと呼ばれている。BLNKはBCR刺激によりリン酸化され、Syk, Btk, PLCγ2, Vav, Grb2等と結合して、それらを介するシグナル経路を活性化する。私達はMAP4Kの1つHPK1がBCRシグナルによりリン酸化され、BLNKのSH2ドメインに結合して活性化し、NF-κBの活性化を促進することを見出した(辻ら 2001)。また、H-Rasが直接BLNKと結合し、それがERK-Elk1経路の活性化に必要であることを見出した(今村ら 2009)。私達が作製したBLNK欠損マウスではB細胞の数が少なく、成熟も障害されていた(林ら2000)。一方で、自己寛容機構の1つ受容体再編が障害され、DNAに結合するB細胞が末梢リンパ組織に存在した(林ら 2004)。また、BCR刺激によるB細胞の活性化・増殖が起こらず、T細胞非依存性抗原に対する抗体産生は起こらなかった。以上より、B細胞の選択、成熟、活性化、増殖を誘導するBCRシグナル伝達にBLNKが重要であることが明らかになった。一方、T細胞依存性抗原に対するIgG抗体の産生は遅れるもののほぼ正常に起こり、抗体の親和性成熟も正常であった(山本ら2004)。
pre-BCRによるB細胞初期分化の誘導機構
プレB細胞に一過性に発現するpre-BCRは一過性の細胞増殖、小型プレB細胞への分化、L鎖遺伝子の再構成を誘導する。BLNK欠損マウスの骨髄にはpre-BCR陽性プレB細胞が蓄積し、その先の分化障害とL鎖再構成の低下が見られた。一方、Η鎖対立遺伝子排除は正常であった(林ら2000, 2003)。以上よりpre-BCRシグナル伝達におけるBLNKの重要性が示された。さらに、BLNK欠損マウス由来のプレB細胞株を用いて、BASH−PKCη−Raf-1−IRF-4というpre-BCRからL鎖再構成誘導に至るシグナル経路を明らかにした(山本ら2006; 小田ら 2008)。
BLNK欠損による白血病の多段階発がん機構
BLNK欠損マウスの数%にはプレB細胞性急性リンパ性白血病 (pre-B ALL) が発症する(林ら 2003)。また、小児のpre-B ALLの一部ではBLNKの発現が消失している。BLNK欠損マウスに発生したpre-B ALLより樹立した細胞株ではJak-STAT5シグナル経路の恒常的活性化が起こっており、その多くでは異所性に発現しているIL-7のautocrineが原因であった。また、活性型STAT5トランスジーンを導入したBLNK+/-マウスのほぼ全例に白血病が発症し、その細胞内のBLNKの発現は消失していた。さらに、BLNKはJak3と直接結合してその活性を抑制し、細胞周期停止とアポトーシスを起こした。以上より、BLNKの発現消失とJak-STAT5経路の恒常的活性化の両者が相互作用し、pre-B ALLの発生を促していると考えられた(中山ら 2009)。
BLNKに会合する新規膜貫通蛋白の機能解析
私たちはBLNKのN末端領域に結合する蛋白として酵母two hybrid法によりBNAS1およびBNAS2という膜貫通蛋白質を同定した。BNAS1は主に小胞体に局在し、BCR架橋によるERK1経路の活性化を負に制御していることが分かった(片平ら2006)。一方、BNAS2はMARVELドメインを共有する8つのメンバーからなるCMTMファミリーの1つで、後にCMTM3と改名された。CMTM3は細胞膜およびエンドソーム膜に局在し、表面IgMのインターナリゼーションに関わることが分かってきた(今村ら 2004)。さらに、CMTMファミリー分子の中で血球系細胞に発現するCMTM7もBLNKに結合することを見出した。CMTM3とCMTM7は4回膜貫通蛋白と推定され、細胞膜で細胞表面IgM(sIgM)およびクラスリンと共局在し、また、初期エンドソームにも局在した。両者ともsIgMの架橋によりsIgMと共に細胞内に取り込まれた。siRNAを用いたノックダウン法により、CMTM7はsIgM架橋によるBLNKのチロシンリン酸化、ERK, JNK, IκB, PKCβの活性化に必要であり、BLNKとSykの会合を仲介していることが分かった。さらに、CMTM7はsIgMとも会合していた。以上より、CMTM7は細胞膜上でsIgMと複合体を形成し、BLNKをリクルートすることによりSykによるBLNKのリン酸化を促進し、BLNK下流のシグナル因子の活性化を促進すると考えられる。この結果はBLNKがBCR複合体にリクルートされシグナル伝達が開始されるまでの新たな機構を提唱するものである(宮崎ら 2012)。
実績
英語の総説
- Kitamura, D. Self-nonself recognition through B-cell antigen receptor. In: Kitamura, D. eds. How the Immune System Recognizes Self and Nonself: Immunoreceptors and Their Signaling. Tokyo: Springer; 2007:99-132.
論文
- Kodama, T., Hasegawa, M., Sakamoto, Y., Haniuda, K. and Kitamura, D. Ubiquitination of IgG1 cytoplasmic tail modulates B cell signaling and activation. Int. Immunol. 2020. In press.
- Koike, T., Harada, K., Horiuchi, S. and Kitamura, D. The quantity of CD40 signaling determines the differentiation of B cells into functionally distinct memory cell subsets. eLife 8: e44245, 2019.
- Litzler, L.C., Zahn, A., Meli, A.P., Hébert, S., Patenaude, A., Methot, S.P., Sprumont, A., Bois, T., Kitamura, D., Costantino, S., King, I.L., Kleinman, C.L., Richard, S. and Di Noia, J.M. PRMT5 is essential for B cell development and germinal center dynamics. Nat. Commun. 10: 22, 2019.
- Takatsuka, S., Yamada, H., Haniuda, K., Saruwatari, H., Ichihashi, M., Renauld, J.-C. and Kitamura, D. IL-9 receptor signaling in memory B cells regulates humoral recall responses. Nat. Immunol. 19: 1025-1034, 2018.
- Le Gallou, S., Zhou, Z., Thai, L.H., Fritzen, R., de Los Aires, A.V., Mégret, J., Yu, P., Kitamura, D., Bille, E., Tros, F., Nassif, X., Charbit, A., Weller, S., Weill, J.C. and Reynaud, C.A. A splenic IgM memory subset with antibacterial specificities is sustained from persistent mucosal responses. J. Exp. Med. 215: 2035-2053, 2018.
- Li, X., Gadzinsky, A., Gong, L., Tong, H., Calderon, V., Li, Y., Kitamura, D., Klein, U., Langdon, W.Y., Hou, F., Zou, Y.R. and Gu, H. Cbl ubiquitin ligases control B cell exit from the germinal-center reaction. Immunity 48: 530-541, 2018.
- Jiménez-Alcázar, M., Rangaswamy, C., Panda, R., Bitterling, J., Simsek, Y.J., Long, A.T., Bilyy, R., Krenn,V., Renné, C., Renné, T., Kluge, S., Panzer, U. Mizuta, R., Mannherz, H.G., Kitamura, D., Herrmann, M., Napirei, M. and Fuchs, T.A. Host DNases prevent vascular occlusion by neutrophil extracellular traps. Science 358: 1202-1206, 2017.
- Haniuda, K., Fukao, S., Kodama, T., Hasegawa, H. and Kitamura, D. Autonomous membrane IgE signaling prevents IgE-memory formation. Nature Immunol. 17: 1109-1117, 2016.
- Domeier, P.P., Chodisetti, S.B., Soni, C., Schell, S.L., Elias, M.J., Wong, E.B., Cooper, T.K., Kitamura, D. and Rahman, Z.S. IFN-γ receptor and STAT1 signaling in B cells are central to spontaneous germinal center formation and autoimmunity. J. Exp. Med. 213: 715-732, 2016.
- Kuraoka, M., Schmidt, A.G., Nojima, T., Feng, F., Watanabe, A., Kitamura, D., Harrison, S.C., Kepler, T.B. and Kelsoe, G. Complex antigens drive permissive clonal selection in germinal centers. Immunity 44: 542-552, 2016.
- Fukao, S., Haniuda, K., Nojima, T., Takai, T. and Kitamura, D. Gp49B-mediated negative regulation of antibody production by memory and marginal zone B cells. J. Immunol. 193: 635-644, 2014.
- Moutai, T., Yamana, H., Nojima, T. and Kitamura, D. A novel and effective cancer immunotherapy mouse model using antigen-specific B cells selected in vitro. PLoS One 9 (3): e92732, 2014.
- Nojima, T., Haniuda, K., Moutai, T., Matsudaira, M., Mizokawa, S., Shiratori, I., Azuma, T. and Kitamura, D. In-vitro derived germinal centre B cells differentially generate memory B or plasma cells in vivo. Nature Commun, 2:465, 2011.
- Haniuda, K., Nojima, T., Ohyama, K. and Kitamura, D. Tolerance induction of IgG+ memory B cells by T-cell independent type II antigens. J. Immunol. 186: 5620-5628, 2011.
- Nakayama, J., Yamamoto, M., Hayashi, K., Satoh, H., Bundo, K., Kubo, M., Goitsuka, R., Farrar, M. A. and Kitamura D. BLNK suppresses pre-B cell leukemogenesis through inhibition of JAK3. Blood 113: 1483-1492, 2009.
- Yamamoto, M., Hayashi, K., Nojima, T., Matsuzaki, Y., Kawano, Y., Karasuyama, H., Goitsuka, R. and Kitamura, D. BASH – novel PKC – Raf-1 pathway of pre-BCR signaling induces kappa gene rearrangement. Blood 108: 2703-2711, 2006.
- Hayashi, K., Yamamoto, M., Nojima, T., Goitsuka, R. and Kitamura, D. Distinct signaling requirements for D selection, IgH allelic exclusion, pre-B cell transition and tumor suppression in B-cell progenitors. Immunity 18: 825-836, 2003.
- Tsuji, S., Okamoto, M., Yamada, K., Okamoto, N., Goitsuka, R., Arnold, R., Kiefer, F. and Kitamura, D. B cell adaptor containing Src Homology 2 domain (BASH) links B cell receptor signaling to the activation of hematopoietic progenitor kinase1. J. Exp. Med. 194: 529-539. 2001.
- Hayashi, K., Nittono, R., Okamoto, N., Tsuji, S., Hara, Y., Goitsuka, R. and Kitamura, D. The B cell-restricted adaptor BASH is required for normal development and antigen receptor-mediated activation of B cells. Proc. Natl. Acad. Sci. USA, 97:2755-2760, 2000.

