昆 俊亮こん しゅんすけ
腫瘍生物学
研究テーマ
- がん変異細胞と正常上皮細胞との細胞競合
- がん細胞と正常間質細胞との相互作用
- 腫瘍リンパ管新生
- がん細胞の足場非依存的増殖能獲得の分子機構
- Wilms腫瘍(小児腎芽腫)の発生機序
経歴
2003年東北大学工学部卒業。2008年同大学にて生命科学博士号取得後、2009年東北大学加齢医学研究所免疫遺伝子制御分野(佐竹正延教授)にて博士研究員、2010年より同助教。2013年北海道大学遺伝子病制御研究所分子腫瘍分野(藤田恭之教授)にて助教、2017年同講師。2018年より本学生命医科学研究所講師。
個体の発生と発がんに多くの共通項を見出すことができるという事実は、生命体が誕生し生命活動を営み続ける限り、常に発がんリスクと対峙していると解釈することができます。しかしながら、個体発生の原理・原則は比較的体系化出来るのに対し、発がんは分散的事象である要因は明確に説明されていません。例えば、個体を構成する組織・器官のどの細胞ががん化しやすいのか?またがん化した細胞は、その誕生直後にどうなるのか?など未だ腫瘍発生学において未解決な課題がたくさん残されております。私たちの研究室では、がん細胞が産生されたときの生体内反応を中心に、発がん研究に取り組んでいます。
1. がん変異細胞と正常上皮細胞との細胞競合
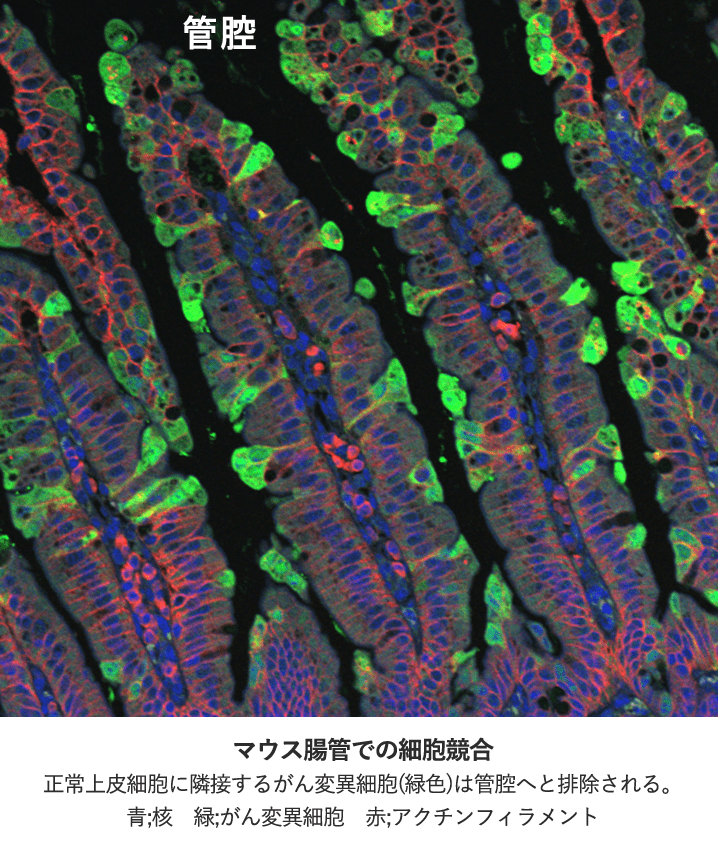
生体の恒常性維持のために、潜在的に危険であったり、もしくは環境に適応していない細胞は組織より排除されます。この排除機構の一つとして、「細胞競合」と呼ばれる現象が細胞社会の秩序を維持していることが近年明らかとなってきました。細胞競合とは、性状の異なる細胞が共在するとき、それらの細胞間相互作用の結果、一方が生存し他方が淘汰される生命現象として定義づけられています。具体的な役割としては、がん変異細胞の排除や、良質な幹細胞の選択、組織の再構成、ひいては個体の発生から寿命まで調節しており、非常に広範な役割を果たしていることが分かってきています。細胞競合現象は、1975年にショウジョウバエで初めて発見されました。私たちは、マウス腸管の少数の上皮細胞にがん変異を誘導することが可能な細胞競合マウスモデルを作出し、哺乳類生体内においても細胞競合によりがん変異細胞が排除されることを世界に先駆けて報告いたしました(Kon et al., 2017, Nature Cell Biology)。現在、このマウスモデルを用いた解析を深化させ、遺伝子変異の蓄積によって細胞競合の機能がどのように変化するのか、また腸管上皮細胞の分化度と細胞競合の機能性(排除効率)との関連について研究を進めています。
2. がん細胞と正常間質細胞との相互作用
腫瘍組織の微小環境では、がん細胞によって教育された癌関連線維芽細胞(CAF)や腫瘍関連マクロファージ(TAM)が腫瘍進展有利に作用することが知られています。しかしながら、がん細胞が間質組織に出現したとき、がん細胞と正常間質細胞との間でどのような細胞間相互作用が生じ、そして正常間質細胞が教育されるのか、その姿は明らかとなっていません。他方、正常間質組織の抗腫瘍的な‘場’‘としての側面も示唆されており、間質組織中にがん細胞が出現したときの実態はよく分かっていません。そこで、様々な悪性度のがん細胞を用意し、正常間質細胞との間でどのような細胞間コミュニケーションが繰り広げられているかを培養細胞とマウス個体内にて解析し、発がんにおける間質組織の役割を明らかにしたいと考えています。
3. 腫瘍リンパ管新生
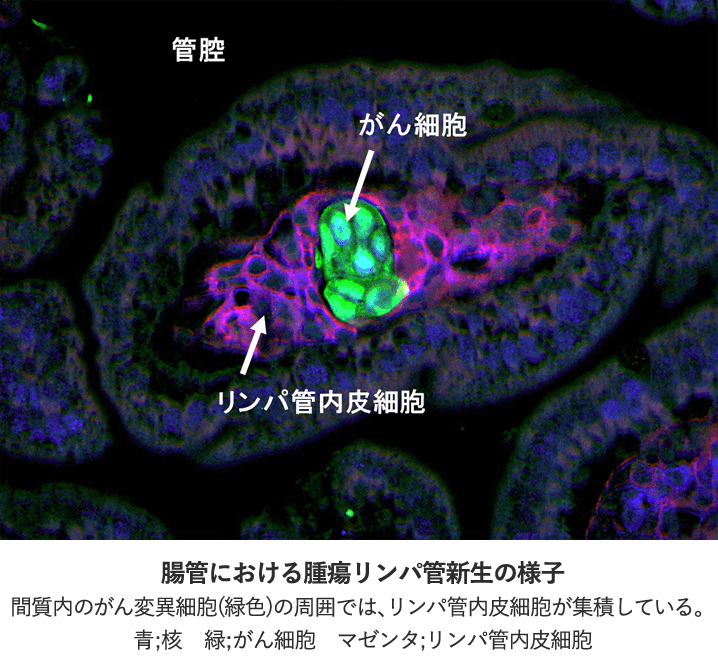
悪性化したがん細胞は、組織内の静脈もしくはリンパ管を通じて遠隔臓器へと転移します。この転移プロセスを抑止することが出来ればがんの治療成績が格段に向上することが期待されるため、がん細胞の脈管侵襲はがん克服のための最重要課題の一つです。がん細胞が腫瘍環境内で血管新生を促し、自己の増殖ならびに転移の支持基盤を構築するメカニズムについて加速度的に研究が進んでいるのに対して、がん細胞が惹起するリンパ管新生の機序はほとんど分かっていません。私たちは、リンパ行性選択的に転移するマウスモデルを用いて、腫瘍リンパ管新生機構を解明し、リンパ管侵襲を標的とした抗がん剤の開発に取り組んでいます。
代表的な業績
- Watanabe, H., Ishibashi, K., Mano, H., Kitamoto, Sho., Sato, N., Hoshiba, K., Kato, Mugihiko., Matsuzawa, F., Takeuchi, Y., Shirai, T., Ishikawa, S., Morioka, Y., Imagawa, T., Sakaguchi, K., Yonezawa, S., Kon, S♯. and Fujita, Y♯. Mutant p53-expressing cells undergo necroptosis via cell competition with the neighboring normal epithelial cells. ♯同等責任著者 Cell Reports, 2018, 23, 3721-2729
- Ishibashi, K., Egami, R., Nakai, K. and Kon, S. An anti-tumorigenic role of the Warbrug effect at emergence of transformed cells. Cell Structure and Function, 2018, 43, 171-176
- Kon, S. Physiological and pathological relevance of cell competition in fly to mammals. Development Growth and Differentiation, 2018, 60, 14-20
- Kon, S*., Ishibashi, K*., Katoh, H., Kitamoto, S., Shirai, T., Tanaka, S., Kajita, M., Ishikawa, S., Yamauchi, H., Yako, Y., Kamasaki, T., Matsumoto, T., Watanabe, H., Egami, R., Sasaki, A., Nishikawa, A., Kameda, I., Maruyama, T., Narumi, R., Morita, T., Sasaki, Y., Enoki, R., Honma, S., Imamura, H., Oshima, M., Soga, T., Miyazaki, J., Duchen, M, R., Nam, J, M., Onodera, Y., Yoshioka, S., Kikuta, J., Ishii, M., Imajo, M., Nishida, E., Fujioka, Y., Ohba, Y., Sato, T. and Fujita, Y. Cell competition with normal epithelial cells promotes apical extrusion of transformed cells through metabolic changes. Nature Cell Biology, 2017, 19, 530-541 *同等筆頭著者
- Kobayashi, N*., Kon, S*., Henmi, Y., Funaki, T., Satake, M. and Tanabe, K. The Arf GTPase-activating protein SMAP1 promotes transferrin receptor endocytosis and interacts with SMAP2. Biochemical and Biophysical Research Communications, 2014, 453, 473-479 *同等筆頭著者
- Kon, S., Kobayashi, N. and Satake, M. Altered trafficking of mutated growth factor receptors and their associated molecules: implication for human cancers. Cellular Logistics, 2014, 4, e28461
- Funaki, T*., Kon, S*., Tanabe, K., Natsume, W., Sato, S., Shimizu, T., Yoshida, N., Wong, W, F., Ogura, A., Ogawa, T., Inoue, K., Ogonuki, N., Miki, H., Mochida, K., Endoh, K., Yomogida, K., Fukumoto, M., Horai, R., Iwakura, Y., Ito, C., Toshimori, K., Watanabe, T. and Satake, M. An Arf GAP-encoding SMAP2 is necessary for the organized vesicles budding from the Trans-Golgi-network and subsequent acrosome formation in spermiogenesis. Molecular Biology of the Cell, 2013, 24, 2633-2644 *同等筆頭著者
- Kon, S., Minegishi, N., Tanabe, K., Watanabe, T., Funaki, T., Wong, W, F., Sakamoto, D., Higuchi, Y., Kiyonari, H., Asano, K., Iwakura, Y., Fukumoto, M., Osato, M., Sanada, S., Ogawa, S., Nakamura, T. and Satake, M. SMAP1 deficiency perturbs receptor trafficking and predisposes mice to myelodysplasia. Journal of Clinical Investigation, 2013, 123, 1123-1137
- Kon, S., Funaki, T. and Satake, M. Putative terminator and/or effector functions of Arf GAPs in the trafficking of clathrin-coated vesicles. Cellular Logistics, 2011, 1, 86-89
- Kon, S., Tanabe, K., Watanabe, T., Sabe, H. and Satake, M. Clathrin dependent endocytosis of E-cadherin is regulated by the Arf6GAP isoform SMAP1. Experimental Cell Research, 2008, 314, 1415-1428

