中村 岳史なかむら たけし
神経科学
研究テーマ
- 軸索生物学:軸索再生の促進と軸索変性の抑制を目指した基礎研究
- 神経細胞内の細胞骨格制御と小胞輸送制御を理解することで損傷を受けた軸索の再生、および老化に伴う軸索の変性をコントロールする道を拓く
経歴
1986年東京大学理学部卒。1991年同大学院修了、理学博士取得(和田昭允教授)。武田薬品工業、住友電気工業、CREST研究員(「脳を守る」)を経て、2003年大阪大学微生物病研究所講師(松田道行教授)。2006年京都大学大学院医学研究科講師(2007年同学大学院生命科学研究科に所属変更)。2010年本学生命科学研究所生命情報科学研究部門教授。
12年前に、神経軸索の再生のプロジェクトを立ち上げるためにTC10 G蛋白質のKOマウスを作りはじめました。その時から、「この仕事をベースにして、近い将来には、軸索変性から神経変性疾患へと研究を広げたい」という希望を持っていました。生憎のコロナ禍で着手が遅れましたが、何とか3年前からそちらのプロジェクトもデータが出るようになり、2025年3月に投稿に漕ぎ着けました。12年前には、まだアルツハイマー病 (AD)の抗体医薬はまだ輪郭くらいしか存在しませんでしたが、レカネマブは予想外のことも伴ってはいるものの、2023年に治療薬として処方されはじめました。しかしながら、AD研究はいろいろな方向に将来への発展性は見えているものの、個人的には、神経変性疾患の理解はまだ全体の15-20%くらいではないかと思います。包括的な理解に至るごく小さなピースでいいので、世界観を変えるような何かを見つけたいと、相変わらず夢を見ています。
5年ぶりのラボ恒例のBBQ。OB、OG、お近くのラボから5名参加
神経突起伸展・成長円錐ガイダンスを制御するシグナル伝達機構の解析
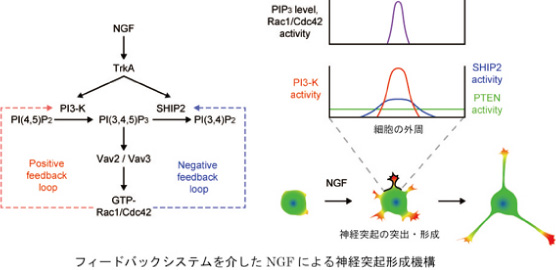
FRETイメージング技術を使ってこの問題に取り組むことを計画した時に、「神経突起伸展シグナルの最小基本要素は何か?」「それはどうやって実現されているのか?」という素朴な疑問から出発しようと考えました。そこで実際にとったのは、異なる刺激(NGFとdbcAMP)による神経突起伸展の系でシグナル伝達経路を比べてみるという単純な方法です。その方針で10年余り研究を続けています。その解析から得た現在の作業仮説は「最小基本要素(のひとつ)は神経突起先端部でのRac1とCdc42の局所的な活性化である」というものです。ただし、その局所活性化がどのように実現されているかは系により大きく異なります。NGF刺激の場合、先端部でポジティブフィードバックループ(PI3キナーゼ、Vav2/3、Rac1とCdc42からなる)とPIP3を代謝するSHIP2を含むネガティブフィードバックループがNGF依存的に回り続けることが局所活性化の実体です。この場合、Rac1とCdc42は先端部で頻繁に活性化・不活性化を繰り返し、突起も伸長と退縮を繰り返します(J. Biol. Chem. 2004; Mol. Biol. Cell 2005; J. Cell Biol. 2007)。これに対しdbcAMPによるRac1の局所的な活性化は、PKAの突起先端部での活性化→STEFリン酸化→Rac1活性化という経路で起こります。またこの場合、Rac1(とCdc42)の局所活性化は持続的であり、突起も比較的単調に伸長します(Mol. Biol. Cell 2011)。これらの知見は、神経突起伸展制御においては比較的少数の基本要素が必要であり、それを様々なやり方で実現することで多様性を実現しているという基本原理の存在を示唆しています。
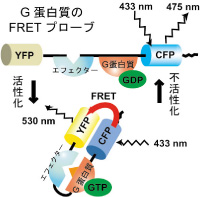
神経突起伸展の実体は、細胞骨格の再編成と小胞輸送による膜の付加です。前者を制御するRhoファミリーG蛋白質の制御機構の理解は近年急速に進んでいます。一方で、後者の中心的制御因子であるRabファミリーG蛋白質が、外部刺激に応答するシグナル経路と膜輸送機能をどう結びつけているかについては未知の部分がまだ沢山あります。そこでFRETイメージングによる局所活性の可視化には膜輸送研究の新局面を切り開く力があると考え、2つのキーテクノロジーを開発しました。まず、従来のFRETセンサーの構造を根本から見直して、「Rab分子センサーの基本デザイン」を確立しました。それにより、膜の取込みに関わるRab5のセンサーを作製し、アポトーシス細胞が貪食される過程での活性変化を可視化しました(Nature 2008)。
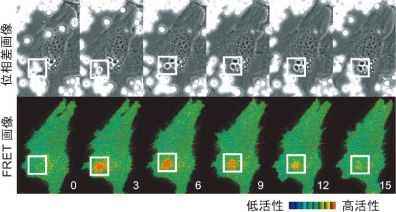
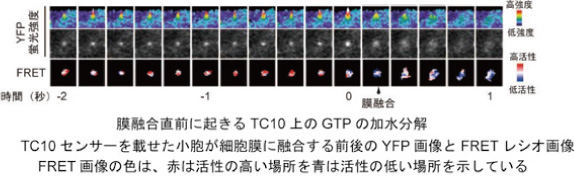
また、膜融合の研究に特に有用な「全反射蛍光顕微鏡を使った高速FRETイメージング法」を世界で初めて報告し、開口放出に関わるG蛋白質TC10の不活性化が膜融合の0.2秒以前に起きていることを突き止めました(Dev Cell 2006)。これらの成果を活用して、Rabファミリーのうち、神経突起伸展に必要なメンバーのFRETセンサーを新たに作製し、成長円錐の伸展過程でそれらキー分子の活性動態を可視化して、活性制御と機能発現のメカニズムを明らかにするプロジェクトを進めています。
神経細胞の機能と恒常性を支える膜輸送の制御機構の解析
神経伝達物質の輸送とシナプスでの授受、また蛋白質の品質管理を中心とした神経細胞の恒常性の維持において、膜輸送は大きな役割を果たしています。これまでの研究により膜輸送に関わる分子群の同定は大きく進みましたが、それらが細胞内でどのような動的ネットワークを作っているのか、そのネットワークがどのように制御されているのかについては多くの部分が未知のままです。膜輸送のキー分子の活性変化をFRETイメージングで可視化することにより、その問題に挑むプロジェクトを進めています。
次世代FRETイメージングシステムの開発
当研究室のコア技術としてのFRETイメージングをさらに発展させ、他のプロジェクトを効率よく進めるために、汎用的なin vivo FRETイメージングシステムの開発を目指して2つの要素技術開発を進めています。
実績
日本語の総説
- 安田さや香、中村岳史: 化学とゲノム医学、化学と教育 61巻3号 (2013).
- 中村岳史、北野正寛、中矢道雄、長田重一、松田道行: 貪食過程における低分子量G蛋白質Rac1とRab5の活性変化 蛋白質核酸酵素 Vol.54: p1114-p1118 (2009)
- 中村岳史、北野正寛、青木一洋、松田道行: FRETプローブによる細胞内シグナル伝達のリアルタイムイメージング 実験医学 Vol.26: p2692-p2698 (2008)
- 中村岳史、青木一洋、松田道行: FRETイメージングとシミュレーションによる神経突起伸展シグナルの解析 実験医学 Vol.25: p1676-p1683 (2007)
- 鯉沼真吾,古澤絵菜,中村岳史 2025. X染色体連鎖性精神遅滞の責任因子Rab39Bの活性可視化 BIO Clinica 40 (4): 106-109.
- 須田亮、中村岳史 2023. 蛍光タンパク質の光明滅・光褪色機構 細胞 55: 67-70.
- 中村岳史、政池知子、須田亮 2020. 極微小空間での生体分子活性の可視化 理大科学フォーラム 419: 4-7.
論文
*corresponding author
- Shingo Koinuma, Misa Miyaji, Suzuka Akiyama, Yashiyuki Ito, Hiroshi Takemura, Naoyuki Wada, Michihiro Igarashi, and Takeshi Nakamura. 2025. TC10 on endosomes regulates the local balance between microtubule stability and dynamics and promotes axon outgrowth through the PAK2-JNK pathway. J. Cell Sci. 138, JCS263636.
- Katsuyuki Kunida, Nobuhiro Takagi, Kazuhiro Aoki, Kazushi Ikeda, Takeshi Nakamura, and Yuichi Sakumura*. 2023. Decoding cellular deformation from pseudo-simultaneously observed Rho GTPase activities. Cell Rep. 42, 112071. doi: 10.1016/j.celrep.2023.112071.
- Shingo Koinuma, Ryota Negishi, Riko Nomura, Kazuki Sato, Takuya Kojima, Eri Nishida-Segi, Ryo Goitsuka, Yoichiro Iwakura, Naoyuki Wada, Yoshiki Koriyama, Sumiko Kiryu-Seo, Hiroshi Kiyama, and Takeshi Nakamura*. 2021. TC10, a Rho family GTPase, is required for efficient axon regeneration in a neuron-autonomous manner. J. Neurochem. 157, 1196-1206. doi: 10.1111/jnc.15235.
- So Morishita, Naoyuki Wada, Mitsunori Fukuda, and Takeshi Nakamura*. 2019. Rab5 activation on macropinosomes requires ALS2, and its subsequent inactivation through ALS2 detachment requires active Rab7. FEBS Lett. 593, 230-241.
- Sayaka Yasuda, So Morishita, Akane Fujita, Tomohisa Nanao, Naoyuki Wada, Satoshi Waguri, Giampietro Schiavo, Mitsunori Fukuda, and Takeshi Nakamura*. 2016. Mon1-Ccz1 activates Rab7 only on late endosome and dissociates from lysosome in mammalian cells. J. Cell Sci. 129, 329-340.
- Akihiro Goto, Mikio Hoshino, Michiyuki Matsuda, and Takeshi Nakamura*. 2011. Phosphorylation of STEF by protein kinase A is critical for Rac1 activation and neurite outgrowth in dbcAMP-treated PC12D cells. Mol. Biol. Cell 22, 1780-1790.
- Masahiro Kitano, Michio Nakaya, Takeshi Nakamura*, Shigekazu Nagata, and Michiyuki Matsuda. 2008. Imaging of Rab5 activity identifies essential regulators for phagosome maturation. Nature 453: 241-245.
- Kazuhiro Aoki, Takeshi Nakamura*, Takanari Inoue, Tobias Meyer, and Michiyuki Matsuda. 2007. An essential role for the SHIP2-dependent negative feedback loop in neuritogenesis of nerve growth factor-stimulated PC12 cells. J. Cell Biol. 177: 817-827.
- Kazuho Kawase, Takeshi Nakamura*, Akiyuki Takaya, Kazuhiro Aoki, Kazuhiko Namikawa, Hiroshi Kiyama, Shuichiro Inagaki, Hiroshi Takemoto, Alan S. Saltiel and Michiyuki Matsuda. 2006. GTP hydrolysis by the Rho-family GTPase TC10 promotes exocytic vesicle fusion. Dev. Cell 11: 411-421.
- Kazuhiro Aoki, Takeshi Nakamura*, Keiko Fujikawa and Michiyuki Matsuda. 2005. Local phosphatidylinositol 3,4,5-triphosphate accumulation recruits Vav2 and Vav3 to activate Rac1/Cdc42 and initiate neurite outgrowth in nerve growth factor-stimulated PC12 cells. Mol. Biol. Cell. 16: 2207-2217.
- Kazuhiro Aoki, Takeshi Nakamura*, and Michiyuki Matsuda. 2004. Spatio-temporal regulation of Rac1 and Cdc42 activity during nerve growth factor-induced neurite outgrowth in PC12 cells. J. Biol. Chem. 279:713-719.

