久保 允人くぼ まさと
免疫学、アレルギー学
研究テーマ
- 制御T細胞による免疫応答の機構
- ヘルパーT細胞(Th1/Th2/Th17/TFH)の分化制御メカニズム
- サイトカインシグナル伝達分子
- 病患モデルマウスシステムの構築
- T細胞による抗体産生誘導の分子メカニズム
- 遺伝子ノックアウトマウス・トランジェニックマウスの作成
経歴
1991年東京大学大学院・医学系研究科(多田富雄教授)にて医学博士を取得後、トロント大学に続きSyntex Research研究所に留学。日本シンテックス新治リサーチセンター免疫研究所、シンテックス・ロシュ免疫研究所の研究員を経て、1995年より東京理科大学・生命科学研究所・免疫生物学部門、2000年より同助教授。 2003年より理化学研究所・横浜研究所・免疫アレルギー科学総合研究センター・チームリーダー、2009年より東京理科大学・生命医科学研究所・分子病態学研究部門・教授(旧 生命科学研究所・生命工学技術研究部門・教授)。理化学研究所・横浜研究所・免疫アレルギー科学総合研究センター・アレルギーオープンラボ・主幹研究員兼担。
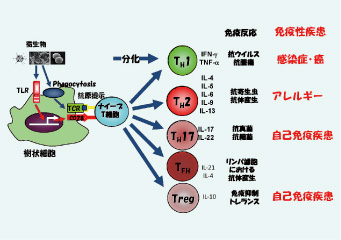
免疫系は数多くの細胞がからみあってその運命決定がなされ、そのお互いのかかわりあいの違いによってその機能の違いが生み出されているわけです。そこには当然のことながら、数え切れないくらい多くの遺伝子の時間的・空間的な発現の変化が関与してきます。特に免疫系の場合、自己・非自己を見分けながら様々な細胞がネットワークを形成し、分化・増殖・機能発現・死が巧妙にプログラムされています。私の研究室では免疫反応の機能発現に直接関連しているサイトカインに焦点を当てて研究を行っています。サイトカインは、免疫システムの細胞から分泌されるタンパク質で、特定の細胞に情報伝達をするとともに、免疫性疾患を司る炎症反応はサイトカインによって規定されていると言って過言ではありません。また、サイトカインは免疫応答に対して促進と抑制の両作用をもつものが存在することにより、過度の炎症反応が起こらないよう巧妙に過剰な免疫反応を調節します。この事から、サイトカインは様々な免疫系細胞の増殖、分化、細胞死を制御する事により、アレルギー炎症・自己免疫性炎症・慢性炎症を構成するとともに、その沈静化を制御する本質とも考えられています。これら免疫細胞のコミュニケーション手段であるサイトカインのネットワークを理解することにより、我々の研究室では免疫恒常性の破綻によって起こる様々な病気のしくみを理解する事を目指しています。
濾胞型ヘルパーT細胞と抗体のクラススイッチの謎
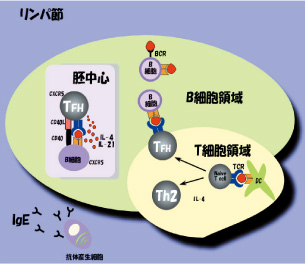
これまで、我々はT h2を中心としたI L -4発現制御過程について解析してきましたが、じつはこのサイトカインは抗体のクラススイッチには欠かせないサイトカインなのです。抗体はB細胞から最終分化したプラズマ細胞から産生され、外来性微生物に対する生体の獲得性免疫において強力な生体防御反応を担う可溶性因子としてよく知られています。 このように、有効な生体防御が行われるにはIgMからIg GやIg Aクラスにスイッチした抗体が必要となるわけです。B細胞がクラススイッチを起こすためには、T細胞の存在が必要とされます。このT細胞に依存する免疫応答に必要なT細胞として、2次リンパ組織に分布してエフェクターとして働くサイトカインを産生する濾胞型ヘルパーT細胞(TF H)の存在が近年になって分かってきました。このTF Hと言うT細胞は、Th2同様IL-4を産生するだけでなく、IL-21を産生することでB細胞にクラススイッチを起こさせ、増殖を誘導してプラズマ細胞への分化・増殖を制御しているのです。しかしながら、TFHの特性やその役割、B細胞がIgGへクラススイッチしてプラズマ細胞に分化する場との関係、クラススイッチや後期B細胞分化を誘導するT- B細胞間相互作用の分子機構、各クラスの抗体産生を誘導するメモリーB細胞の生存・維持の場など、数多くの疑問が残されています。そこで、われわれはこれら疑問に答えるべく遺伝子工学的な手法とイメージングを組み合わせることにより、抗体が作られる過程をモニターできる新たなシステムを構築することにチャレンジをしていきたいと思います。 最近、我々は上記のCNS-2と呼ばれるIL-4遺伝子座の制御領域が、TFHにおけるIL-4産生を決める重要なゲノム領域であることを発見しました。この発見により従来考えられていた抗体産生に関わるT細胞の概念が変わろうとしています(Immnity,2012,)。
アレルギー炎症を制御する分子メカニズム
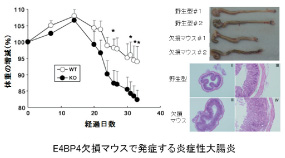
1)アレルギーを制御するI L -4遺伝子の発現制御機構を理解する目的で、ゲノム上に存在する制御領域の働きを知るため、緑色蛍光蛋白GF Pをレポーターにしたトランスジェニックマウスのシリーズを構築した。これらの解析から、いくつかの制御領域(プロモーター、HS2、サイレンサー、HS4、CNS-2)の存在が明らかになりました。その一つ、CNS-2領域はリンパ濾胞型ヘルパーT細胞(TFH)メモリー型CD4T細胞やNKT細胞等におけるIL-4産生を、Notchシグナルを介して制御する働きがある事が分かってきました( Immunity, 2004, Immunity, 2006, Immunity,2007,Immunity,2012,)。 2)IL-4遺伝子の転写制御領域を更に解析する目的で、それぞれの制御領域をゲノムから欠損させたマウスシリーズを作製しました。この解析からアレルギー反応に関わるサイトカイン I L -4の遺伝子座上に、T h2マスターレギュレーターである「GATA-3」が結合するHS2領域を同定した。従来から、「G ATA -3」がどうのように複数のT h2サイトカイン遺伝子の産生スイッチを同時に制御するのかそのメカニズムについては不明であった。複数のT h2サイトカイン遺伝子がクラスターで存在する遺伝子座を包括的に制御する機構が提唱されていました。我々の研究から、異なるT h2サイトカイン遺伝子には、それぞれ「GATA-3」が結合する遺伝子配列が存在することが明らかされ、それぞれのT h2サイトカイン遺伝子は独立して、制御されていることが証明されました。そのため、HS2欠損T細胞は、IL-4を産生すること無く、IL-13やIL-5を発現できます。HS2欠損マウスでは、IL-4を産生できないため、喘息やIg E産生などのアレルギー反応を全く起こさなくなりました(Nature Immunology 12, No.1、77-85, 2011)。__一方、砂金我々のグループでは、TFHでIL-4の産生を制御している領域として、I L -4遺伝子座下流に位置する制御領域、CNS-2を同定しました。この領域は抗体産生特に、アレルギーに関わるIgE抗体を作る上で重要な働きを持つことが明らかにされました (,Immunity,2012)。炎症反応を沈静化する分子メカニズム炎症反応を抑制するサイトカインI L -10の発現が、時計遺伝子の転写因子E 4B P4によって制御されていることを発見し、免疫反応の沈静化に働くメカニズムを解明しました。I L -10を産生するT細胞として、もっとも代表的な細胞はT h2細胞であるが、N KT、メモリーT細胞、制御性T細胞など様々なT細胞がこのサイトカインを産生する。ところが、E4BP4欠損マウスでは、いずれの細胞からのI L -10も顕著に減弱していました。また、慢性炎症状態ではT h1からI L -10や I L -13が可塑的に産生されるようになり、この産生もE4B P4によって制御されています。また、E4B P4欠損マウスは様々な自己免疫性大腸炎・自己免疫性多発性硬化症などの自己免疫性疾患を起こしやすくなります( Nature Immunology 12、No.5:450-459, 2011)。
皮膚炎症を制御する分子メカニズム: アトピー性皮膚炎モデル 乾癬モデルマウスの構築
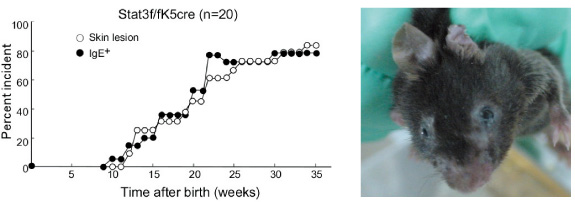
STAT3は様々な炎症性サイトカインの下流でその活性を制御するシグナル分子です。この分子に変異を持つヒト患者は、高Ig E血症を発症し、重度のアトピー様の皮膚炎を発症することが知られている。S O C S3はS TAT3の働きを抑制的に制御するシグナル分子です。皮膚特異的にS O C S3あるいはS TAT3を欠損するマウスを作成すると、いずれのマウスも生後15週令を過ぎると皮膚炎を自然発症するとともに、Ig E抗体価が上昇します。すなわち、皮膚でシグナルが亢進された場合、シグナルが入らなくなった場合いずれにおいても、アトピー様の皮膚炎が発症します。興味深いことにS TAT3の欠損マウスでみられる皮膚炎は、IgE反応がないI L -4R欠損マウスとの掛け合わせでは、皮膚炎の発症が消失します。一方、SO C S3欠損マウスでみられる皮膚炎は、この条件でも皮膚炎の改善は見られません。この事から、S TAT3欠損マウスでみられる皮膚炎は、T h2反応を介するアトピー性の炎症であるのに対し、SO C S3欠損マウスでみられる皮膚炎は、T h17を介した皮膚炎である乾癬様の病変であることが分かりました。従って、STAT3の欠損マウスはアトピー性皮膚炎のモデル、SO C S3欠損マウスは乾癬のモデルとしての有効性が想定される訳です(Plos One 2012)。
実績
論文
- Motomura, Y., Morita, H., Moro, K., Nakae, S., Artis, D., Koyasu,S., Kubo, M. Basophil-derived IL-4 controls the function of natural helper cells, a member of ILC2s, in lung inflammation. Immunity 40, Issue 5, p758–71, May 2014.
- Kubo, M. TCF-1 and LEF-1 help launch the TFH program, Nature Immunology, 16(9):900-1, Sep 2015.
- Miyauchi, K., Sugimoto-Ishige, A., Harada, Y., Adachi, Y., Usami, Y., Kaji, T., Hasegawa, H., Watanabe, T., Hijikata, A., Fukuyama, S., Maemura, T., Ohara, O., Kawaoka, Y., Takahashi, Y., Takemori, T., and Kubo, M. Protective neutralizing influenza antibody response in the absence of T follicular helper cells. Nature Immunology 17(12):1447-1458, Dec 2016.
- Dominguez-Huttinger, E. E., Christodoulides, P., Miyauchi, K., Irvine, AD., Okada-Hatakeyama, M., Kubo, M. and Reiko J Tanaka, RJ., Mathematical modeling of atopic dermatitis reveals “double-switch” mechanisms underlying 4 common disease phenotypes. J. Allergy Clin Immunol.139(6):1861-1872 e7, Jun 2017.
- Wang,Y., Zheng Kuang, Xiaofei Yu, Kelly A. Ruhn, Kubo, M., and Lora V. Hooper, The intestinal microbiota regulates body composition through NFIL3 and the circadian clock. Science 357(6354):912-916,Sep 2017.
- Kubo, M., Mast cells and basophils in allergic inflammation, Current Opinion in Immunology Current Opinion in Immunology, 54, 74-79, October 2018.
- Takamura, S., Kato, S., Motozono, C., Shimaoka, T., Ueha, S., Matsuo, K., Miyauchi, K., Masumoto, T., Katushima, A., Nakayama, T., Tomura, M., Matsushima, K., Kubo, M. and Miyazawa, M. Interstitial-resident memory CD8+ T cells sustain frontline epithelial memory in the lung, J. Exp. Med. 216(12):2736-2747 Dec 2019.
- Sasaki, T., Yajima, T., Shimaoka, T., Ogawa, S., Saito, T., Yamaoka, K., Takeuchi, T., Kubo, M. Synergistic effect of IgG4 antibody and CTLs causes tissue inflammation in IgG4-related disease. Int. Immunol. 32(3), 163-174, Mar 2020.
- Kubo, M. Miyauchi, K. Breadth of Antibody Responses during Influenza Virus Infection and Vaccination, Trends in Immunology. 2020 Apr 4. doi: 10.1016/j.it.2020.03.005
- 実験医学 特集 「慢性アレルギー炎症―免疫系の役者たちの新たな姿 T細胞・好塩基球,サイトカインが織りなす慢性化のメカニズムとワクチン開発」 羊土社 Vol. 30, No.6, p886-892, 2012
- 日経電子版 2011年4月4日 http://release.nikkei.co.jp/detail.cfm?relID=277419&lindID=4
- 科学新聞 2011年4月22日 http://www.rs.noda.tus.ac.jp/~ribsjm/news/the_science%20_news.pdf
- 科学工業日報 2011年8月15日 http://www.rs.noda.tus.ac.jp/~ribsjm/kubolab/images/news.pdf
- 日本経済新聞 夕刊 2011年8月15日 http://www.rs.noda.tus.ac.jp/~ribsjm/kubolab/images/news.pdf
- 朝日新聞 2011年8月16日 http://www.rs.noda.tus.ac.jp/~ribsjm/kubolab/images/news.pdf
- 科学新聞 2011年8月26日 http://www.rs.noda.tus.ac.jp/~ribsjm/kubolab/images/news.pdf
- マイナビニュース 2月29日 http://news.mynavi.jp/news/2012/02/29/011/index.html

