後飯塚 僚ごいつか りょう
発生免疫学・再生生物学
研究テーマ
- ホメオボックス転写因子による幹細胞の未分化状態維持機構
- アレルギー炎症における肥満細胞と好塩基球の機能
- 胸腺ニッチの維持再・生の分子機構
- 免疫系の恒常性維持の分子機構
- 遺伝子ノックアウトマウスの作成と解析
経歴
1984年東京大学農学部卒。1987年同大学獣医内科学教室助手。1993年米国アラバマ大学比較臨床発生免疫学研究部門(Prof.Max D.Cooper)客員研究員。1995年科学技術振興事業団さきがけ研究21「遺伝と変化」領域(豊島久真男統括)専任研究員。1997年本学生命科学研究所分子生物学研究部門助教授。2007年より同研究所発生および老化研究部門教授。
生命とは、自己破壊と自己創造が絶え間なく繰り返されている「場」であり、生と死のバランスの上に成立している生命は、その時間の中で、常に「新しい自己」として生まれ変わり続けているともいえる。そして、そのバランスの時間的維持こそが生命という高次システムの恒常性の維持(ホメオスタシス)であり、恒常性の破綻の過程が「老化」であり、その帰着として「生命の死」が到来すると定義できるだろう。しかしながら、遺伝子、細胞、器官、その総体としての個体、それぞれの階層における死には齟齬がある。個体が死滅しても、個体の外で細胞は生き延びることが可能であり、器官が死滅しても、個体は疑似器官によって生存可能である。そして、今や、細胞核の保存は個体の復元をも保証する時代になりつつある。それでもなお、生命とは時間的存在であるという意味において、死に向かう過程としての老化という現象は、全ての階層に共通するものであろう。2006年に新たにリニューアルされて、その産声をあげた本研究部門の現在進行形のプロジェクトを以下に紹介する。
分化の場としてのNiche(ニッチ)の維持・再生の制御
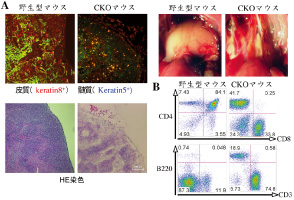 成体胸腺ニッチの維持・再生の転写因子による制御 上皮細胞における転写因子欠損による 胸腺の消失(A)とリンパ節様転換(B)
成体胸腺ニッチの維持・再生の転写因子による制御 上皮細胞における転写因子欠損による 胸腺の消失(A)とリンパ節様転換(B)
1 胸腺はT細胞が分化する器官である。胸腺という場(ニッチ)を構成する特殊な上皮細胞との相互作用により、骨髄由来細胞が胸腺に移住し、分化・増殖が誘導され、その結果として自己反応性の細胞は除去され、ウイルスや異物に反応できるT細胞のみが選択されて、末梢リンパ組織に送られる。しかし、胸腺は年齢とともに急速に退縮し、そのニッチとしての機能を消失していく。そして、この胸腺の退縮が、易感染性や発癌などの老化に伴う免疫系による生体防御・監視機能低下の一因と考えられている。 我々は、現在までに、ストレス後の胸腺上皮細胞再生時に発現が増強する転写因子に着目し、本転写因子の上皮細胞特異的なコンディショナルノックアウトマウス(CKO)において、胸腺ニッチが消失することを明らかにしている。胸腺ニッチ幹細胞の維持に本転写因子が関与しているのではないかという仮説のもと、本転写因子の発現細胞、すなわち胸腺ニッチ幹細胞の同定、それを用いた胸腺ニッチの再構成、ならびに転写因子を用いたリプログラミングによる人工胸腺ニッチ構築の可能性に向かって研究を進めており、生体で最も早く老化・消滅する器官である胸腺をモデルにして、器官の老化と再生の問題に取り組んでいる。
組織幹細胞のSelf-renewal(自己再生)の制御
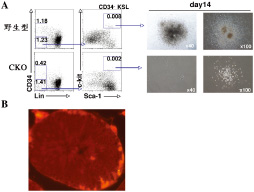 造血幹細胞の維持に関わる転写因子(A)と 精原細胞における発現(B)
造血幹細胞の維持に関わる転写因子(A)と 精原細胞における発現(B)
幹細胞は発生や組織の再生など、生体の恒常性維持において最も重要な細胞であり、その自己複製能ならびに多分化能は、それぞれの組織におけるニッチとの相互作用や幹細胞に内在する特殊な分子機構により厳密に制御されているものと考えられている。したがって、生体時間(老化)に伴う遺伝子変異の蓄積や幹細胞性の疲弊は、白血病や癌、貧血や組織機能不全という生体にとって致命的な恒常性破綻をもたらすことになる。 これらの背景をふまえ、我々は、現在、細胞系列ならびに時期特異的コンディショナルノックアウトマウスを用いて、造血系と生殖系列という二つのシステムにおける幹細胞の維持、自己複製の制御機構について転写因子の面から研究を進めている。現在までに、白血病関連遺伝子として発見された転写因子の正常造血系における解析から、本転写因子が造血幹細胞特異的に高発現しており、それを欠損させると、造血幹細胞の自己複製能が消失し、造血系が維持できなくなることを見出している(下図A)。また、精巣での精子形成に関与する単能性組織幹細胞である精原幹細胞にも、同ファミリー転写因子の一つが発現していることから(下図 B)、造血幹細胞と同様に、精原幹細胞の維持に関与している可能性について、ノックアウトマウスを用いて解析を始めているところである。
生体時間情報としての記憶の形成・維持の制御
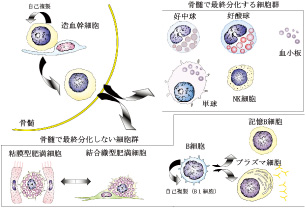 時間情報を維持する細胞群
時間情報を維持する細胞群
生体には、短命な細胞もあれば、また寿命の長い細胞も存在する。その寿命の長い細胞の代表が幹細胞であり、そこから様々な分化経路を経て、最終分化した赤血球のような細胞は概ね短命である。しかしながら、分化した細胞の中にも、生体の時間情報を維持するために、すなわち、記憶するために、長期に生存する細胞がいる。感染やワクチン接種などの過去の履歴を維持し続けるメモリーB細胞、メモリーT細胞、抗体を長期にわたって産生し続ける長期生存形質細胞、アレルギー発症の中心的役割を担う肥満細胞などが、そうである。これらの細胞は、それぞれが生体の中の特殊な場(ニッチ)で、あたかも冬眠しているがごとく維持されていると考えられている。例えば、肥満細胞は、消化管粘膜や皮膚結合織などの組織中で成熟し、そこで長期にわたり生存し、粘膜型或いは結合織型という肥満細胞の二つの表現系は環境によって可逆的に分化転換可能であることが明らかになっている。我々は、これらの細胞がどのような分子機構で形成され、また維持されているのかという問題について、研究を始めているところであり、細胞分化の可塑性、幹細胞性との関連からも、生体時間の維持の制御機構を明らかにしていこうと考えている。
実績
論文・総説など
- Ueno, Y., Fujisaki, K., Hosoda, S., Amemiya, Y., Okazaki, S., Notsu, C., Nishiyama, C. Mabuchi, Y., Matsuzaki, Y., Oda, A, and Goitsuka, R.: Transcription factor Tlx1 marks a subset of lymphoid tissue organizer-like mesenchymal progenitor cells in the neonatal spleen. Scientific Reports, 9 (1): 20418. (2019)
- Namekata, M, Yamamoto, M. and Goitsuka, R.: Nuclear localization of Meis1 in dermal papilla promotes hair matrix proliferation in the anagen phase of hair cycle. Biochem. Biophys. Res. Commun. 519(4):727-733.(2019)
- Oda, A, Ueno, Y.,Hosoda, S., Amemiya, Y., Notsu,C., Tezuka, T., Kasahara, T., Nishiyama, N. and Goitsuka, R.: Niche-induced extramedullary hematopoiesis in the spleen is regulated by the transcription factor Tlx1. Scientific Reports, 8:8308, (2018)
- Tashiro, Y., Murakami, A., Hara, Y., Shimizu, T., Kubo, M., Goitsuka, R., Kishimoto, K. and Azuma, T.:High-affinity IgM+ memory B cells are defective in differentiation into IgM antibody-secreting cells by re-stimulation with a T cell-dependent antigen. Scientific Reports, 8:14559 (2018)
- Kawai, Y., Oda, A., Kanai, Y., and Goitsuka, R.: Germ cell-intrinsic requirement for the homeodomain transcription factor PKnox1/Prep1 in adult spermatogenesis. PLosOne, 2018, 13(1): e0190702.
- Owa, T, Taya S, Miyashita, S, Yamashita, M, Adachi, T, Yamada, K, Yokoyama, M, Aida, S, Nishioka, T, Inoue, YU, Goitsuka, R, Nakamura, T, Inoue, T, Kaibuchi, K and Hoshino, M.: Meis1 coordinates cerebellar granule cell development by regulating Pax6 transcription, BMP signaling and Atoh1 degradation. J Neurosci., 2018, 38(5):1277-1294.
- 7Yokoyama, T., Nakatake, M., Kuwata, T., Goitsuka, R., Tsutsumi, S., Aburatani, H., Valk, P. J. M., Delwel, R. and Nakamura, T.: Tranactivation of Styl1/Slp1 by Meis1 promotes CXCL12/CXCR4 signaling and myeloid leukemogenesis in vivo. J. Clin. Invest., 2016, 126:1664-1678
- Yoshioka, K., Kawai, Y., Oda, A., Notsu, C. Mabuchi, Y., Suzuki, S., Matsuzaki, Y., and Goitsuka, R.: Loss of Homeodomain Transcription Factor Prep1 Perturbs Adult Hematopoiesis in The Bone Marrow. Plos One, 2015, 10, e0136107.
- Tashiro, Y., Murakami, A., Goitsuka, R., Shimizu, T., Kishimoto, H., and Azuma, T.: An asymmetric antibody repertoire is shaped between plasmablasts and plasma cells after secodary immunization with (4-hydroxy-3-nitrophenyl)acetyl chicken gamma-globulin. Int. Immunol., 2015, 27 (12):609-620.
- 小田朗永、後飯塚僚:成体脾臓における髄外造血ニッチとその構成要素.「医学のあゆみ」 第264巻3号、258-259、2018
- 後飯塚僚:間葉系ストローマ細胞による造血制御とその応用.家畜感染症学会誌 第5巻2号、2016

