小川 修平おがわ しゅうへい
免疫生物学、発生工学
研究テーマ
- T細胞機能発現における補助シグナルの分子メカニズムの解析
- T細胞の活性化、機能発現における短鎖脂肪酸受容体シグナルの役割の解析
- 遺伝子改変マウスの作製
経歴
1997年東京理科大学理工学部応用生物科学科卒業。2002年同大学生命医科学研究科(安部良教授)にて博士(理学)取得後、同大学薬学研究科ゲノム創薬研究センターポストドクトラル研究員、2004年同大学生命医科学研究所助教、2016年より同講師。
T細胞は抗原を提示する抗原提示細胞(APC:Antigen Presenting Cell)との細胞間相互作用に基づく抗原提示により活性化され、様々な機能を担う機能的T細胞へと分化します。 この際、抗原特異的活性化シグナルの他に、APC 上の B7、T細胞上の CD28/CTLA-4 分子との結合によるシグナル(補助シグナル)が伝えられ、T細胞の抗原に対する反応性が決定されます。我々はこの補助シグナル分子の細胞内領域に点変異を持つ遺伝子改変マウスを用いて、T細胞の機能発現における補助シグナルの分子メカニズムを解明するために研究を行っています。 近年、非常に注目されている腸内細菌の免疫応答への影響にも興味を持ち、食物繊維が腸内細菌によって分解されて産生される短鎖脂肪酸がT細胞の反応にどのような機能を持つのかを、短鎖脂肪酸欠損マウスを用いて解析を行っています。
CD28補助シグナルの細胞内シグナル伝達メカニズムの解析
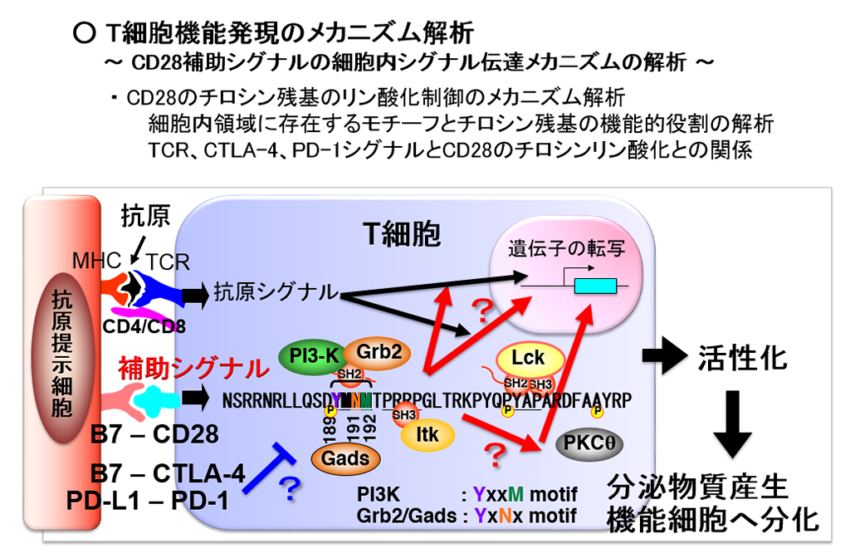
CD28分子は免疫応答において重要な働きをしていることが明らかとなっていますが、CD28分子によって誘導されるT細胞の活性化機構を詳細に理解するためにはCD28分子を介する細胞内シグナル伝達機構を知ることが必要です。我々はCD28シグナル伝達機構を解析するため、他の分子との結合に重要であると考えられる細胞内領域のアミノ酸に変異を導入した変異CD28遺伝子を作製しました。これまでに、CD28シグナルによって誘導されるIL-2 promoterの活性化をGrb2は正に、PI3-Kは負に制御することを示しました。さらに、CD28の細胞内領域に存在するYMNMモチーフ内のチロシン残基がCD28のチロシンリン酸化に必須であり、in vivoにおけるT細胞機能の発現に重要な役割を果たしていることを明らかにしました。また、CD28の細胞内領域のC末側にはPxxP motifが2カ所存在し、これらに点変異を導入したCD28を発現するマウスを作製の解析から、どちらのPxxPモチーフもT細胞の増殖やIL-2産生において促進的な役割があることを明らにしました。現在、これまで調べたアミノ酸残基以外にもCD28補助シグナルの機能に重要なアミノ酸残基がある可能性を見いだしており、これらアミノ酸の点変異を持つ遺伝子改変マウスを作製することによりそれらアミノ酸残基の役割を明らかにしようと試みています。
T細胞の機能発現における腸内細菌及び短鎖脂肪酸の役割の解析
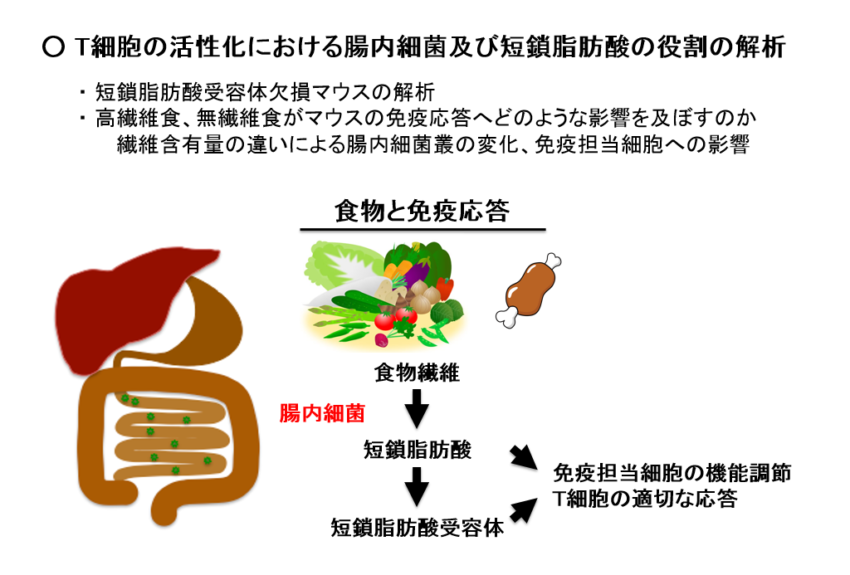
近年、腸内細菌が生体の高次機能に深く関わっていることが明らかになりつつあります。我々は、食物繊維が腸内細菌によって分解されてできる短鎖脂肪酸と免疫応答との関係を検討し、短鎖脂肪酸あるいは短鎖脂肪酸受容体の人為的制御により腫瘍免疫の賦活化やアレルギーなど過剰な免疫応答の抑制が可能かを検討しています。本研究プロジェクトは新しいプロジェクトであるため、学術論文にはまだ報告していませんが、ある短鎖脂肪酸受容体のノックアウトマウスを用いた解析で、この短鎖脂肪酸受容体がT細胞のIL-2産生に抑制的に働く可能性を見つけています。今後、学術論文に報告する予定です。また、現在、食物繊維の含量が異なる飼料(無繊維食、標準食、高繊維食)を摂取させ、T細胞の機能にどのような差が生じるのかを検討する予定です。
遺伝子改変マウスの作製
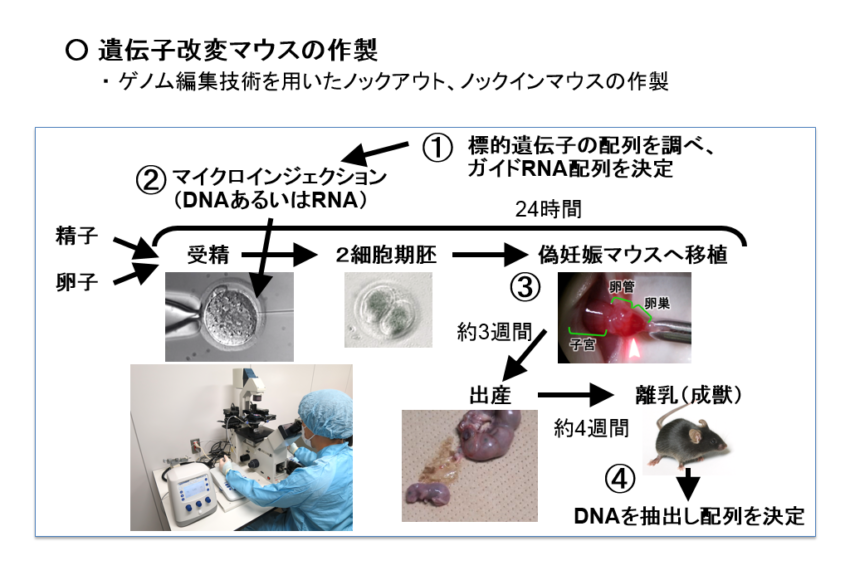
我々のグループでは、ライフサイエンス研究の進展や人類の健康に大きく貢献している、遺伝子組換えマウスの作製を行っています。生命科学の発展に貢献するため、遺伝子改変マウス作製の委託事業をヒト疾患モデル研究センターで行っています。ご興味のある方はご連絡ください。
代表的な業績
- Ogawa S, Abe R. Signal Transduction Via Co-stimulatory and Co-inhibitory Receptors. Adv Exp Med Biol. 2019;1189:85-133.
- Wakamatsu E, Omori H, Tabata Y, Akieda Y, Watanabe S, Ogawa S, Abe R. CD28 co-stimulation is dispensable for the steady state homeostasis of intestinal regulatory T cells. Int. Immunol. 30(4): 171-180, 2018
- Inaba S, Numoto N, Ogawa S, Morii H, Ikura T, Abe R, Ito N, Oda M. Crystal Structures and Thermodynamic Analysis Reveal Distinct Mechanisms of CD28 Phosphopeptide Binding to the Src Homology 2 (SH2) Domains of Three Adaptor Proteins. J Biol Chem. 292(3): 1052-1060, 2017
- Ohtsuka S, Ogawa S, Wakamatsu E, Abe R. Cell cycle arrest caused by MEK/ERK signaling is a mechanism for suppressing growth of antigen-hyperstimulated effector T cells. Int Immunol. 28(11): 547-557, 2016
- Akieda Y, Wakamatsu E, Nakamura T, Ishida Y, Ogawa S, Abe R. Defects in regulatory T cells due to CD28 deficiency induce a qualitative change of allogeneic immune response in chronic graft-versus-host disease. J Immunol. 194(9): 4162-74, 2015
- Obata Y, Toyoshima S, Wakamatsu E, Suzuki S, Ogawa S, Esumi H, Abe R. Oncogenic Kit signals on endolysosomes and endoplasmic reticulum are essential for neoplastic mast cell proliferation. Nat Commun. 5:5715, 2014
- Higo K, Oda M, Morii H, Takahashi J, Harada Y, Ogawa S, Abe R. Quantitative analysis by surface plasmon resonance of CD28 interaction with cytoplasmic adaptor molecules Grb2, Gads and p85 PI3K. Immunol Invest. 43(3): 278-91, 2014
- Ogawa S, Watanabe M, Sakurai Y, Inutake Y, Watanabe S, Tai X, Abe R. CD28 signaling in primary CD4(+) T cells: identification of both tyrosine phosphorylation-dependent and phosphorylation-independent pathways. Int Immunol. 25(12): 671-81, 2013
- Watanabe M, Nakajima S, Ohnuki K, Ogawa S, Yamashita M, Nakayama T, Murakami Y, Tanabe K, Abe R. AP-1 is involved in ICOS gene expression downstream of TCR/CD28 and cytokine receptor signaling. Eur J Immunol. 42(7): 1850-62, 2012
- Watanabe S, Ohnuki K, Hara Y, Ishida Y, Ikarashi Y, Ogawa S, Kishimoto H, Tanabe K, Abe R. Suppression of Con A-induced hepatitis induction in ICOS-deficient mice. Immunol Lett. 128(1): 51-8, 2010
- Takeda K, Harada Y, Watanabe R, Inutake Y, Ogawa S, Onuki K, Kagaya S, Tanabe K, Kishimoto H, Abe R. CD28 stimulation triggers NF-kappaB activation through the CARMA1-PKCtheta-Grb2/Gads axis. Int Immunol. 20(12):1507-15, 2008
- Watanabe M, Takagi Y, Kotani M, Hara Y, Inamine A, Hayashi K, Ogawa S, Takeda K, Tanabe K, Abe R. Down-regulation of ICOS ligand by interaction with ICOS functions as a regulatory mechanism for immune responses. J Immunol. 180(8):5222-34, 2008
- Suzuki T, Ogawa S, Tanabe K, Tahara H, Abe R, Kishimoto H. Induction of antitumor immune response by homeostatic proliferation and CD28 signaling. J Immunol. 180(7):4596-605, 2008
- Watanabe R, Harada Y, Takeda K, Takahashi J, Ohnuki K, Ogawa S, Ohgai D, Kaibara N, Koiwai O, Tanabe K, Toma H, Sugamura K, Abe R. Grb2 and Gads exhibit different interactions with CD28 and play distinct roles in CD28-mediated costimulation. J Immunol. 177(2):1085-91, 2006
- Watanabe S, Ogawa S, Hara Y, Tanabe K, Toma H, Abe R. Expression level of costimulatory receptor ICOS is critical for determining the polarization of helper T cell function. Transpl Immunol. 15(4):255-63, 2006
- Kotani M, Hirata K, Ogawa S, Habiro K, Ishida Y, Tanuma S, Horai R, Iwakura Y, Kishimoto H, Abe R. CD28-dependent differentiation into the effector/memory phenotype is essential for induction of arthritis in interleukin-1 receptor antagonist-deficient mice. Arthritis Rheum. 54(2):473-81, 2006
- Okano K, Nitta K, Ogawa S, Horita S, Habiro K, Nihei H, Abe R. Effects of double blockade of CD28 and inducible-costimulator signaling on anti-glomerular basement membrane glomerulonephritis. J Lab Clin Med. 144(4):183-92, 2004
- Nitta K, Horita S, Ogawa S, Matsumoto M, Hara Y, Okano K, Hayashi T, Abe R, Nihei H. Resistance of CD28-deficient mice to autologous phase of anti-glomerular basement membrane glomerulonephritis. Clin Exp Nephrol. 2003 Jun;7(2):104-12.
- Ogawa S, Nagamatsu G, Watanabe M, Watanabe S, Hayashi T, Horita S, Nitta K, Nihei H, Tezuka K, Abe R. Opposing effects of anti-activation-inducible lymphocyte-immunomodulatory molecule/inducible costimulator antibody on the development of acute versus chronic graft-versus-host disease. J Immunol. 167(10):5741-8, 2001
- Harada Y, Tokushima M, Matsumoto Y, Ogawa S, Otsuka M, Hayashi K, Weiss BD, June CH, Abe R. Critical requirement for the membrane-proximal cytosolic tyrosine residue for CD28-mediated costimulation in vivo. J Immunol. 166(6):3797-803, 2001
- Ogawa S, Nitta K, Hara Y, Horita S, Nihei H, Abe R. CD28 knockout mice as a useful clue to examine the pathogenesis of chronic graft-versus-host reaction. Kidney Int. 58(5):2215-20, 2000

