吉村 昭彦よしむら あきひこ
免疫学、生化学
研究テーマ
- NR4aによる腫瘍免疫の制御
- 免疫老化の制御機構の解明
- 脳関連疾患における免疫の意義の解明と治療応用
経歴
1981年京都大学理学部卒業。1986年京都大学理学博士。大分医科大学生化学教室・助手、鹿児島大学医学部 腫瘍研究施設・助手、助教授を経て1995年 久留米大学分子生命科学研究所・教授、2001年 九州大学生体防御医学研究所・教授 2008年 慶應義塾大学医学部・免疫微生物学教室 教授。2024年より本学生命医科学研究所 分子病態学部門 教授。1989-1991年アメリカ合衆国MITホワイトヘッド研究所に留学。令和3年度紫綬褒章、令和4年度国際サイトカイン学会ファイザー賞、令和5年度東レ科学技術賞などを受賞。
私たちはこれまで⼀貫して免疫応答制御の分⼦レベルでの解明を⽬指してきました。特にサイトカインの主要シグナル経路であるJAK/STAT 経路とRas/ERK 経路を負に制御する因⼦CIS/SOCS ファミリーとSPRED ファミリーを発⾒し、サイトカインシグナルに負の調節機構が存在することを世界で初めて⽰すとともに、これらの分⼦群が『免疫が自己や食物など無害な物に対して反応しない』すなわち「免疫寛容」という現象を担う分子群であることを明らかにしました。さらにサイトカインやこれらの制御分⼦の発現を調節し、「免疫寛容」のかなめとなる転写因⼦NR4a を発⾒し、現在、腫瘍免疫や⽼化の分野でT細胞とNR4a を中心に精⼒的に研究を進めています。また脳梗塞において制御性T 細胞が神経保護に働くことを発⾒するなど、これまで気づかれていなかった脳と免疫の関係を明らかにする研究も行っています。
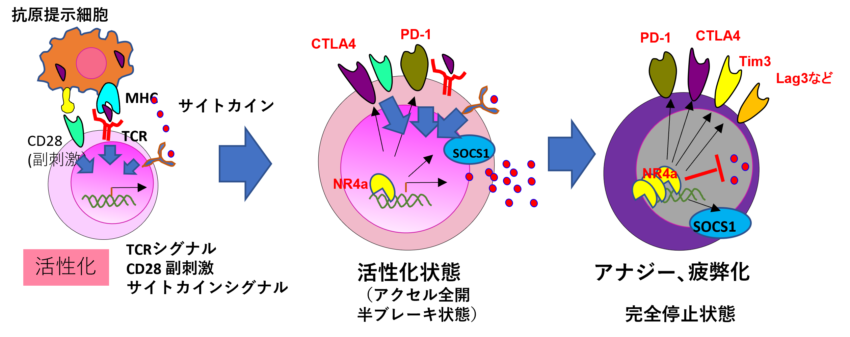
T細胞の活性化と停止機構 T細胞の活性化には抗原提示細胞のMHC-抗原複合体によるTCR刺激、。CD28による副刺激、それにサイトカインの刺激が必要です。これらはT細胞活性化のアクセルと言えます。続いて過剰な活性を抑えるために、負のブレーキが働き始めます。ブレーキ分子であるPD-1はチロシン脱リン酸化酵素をTCRの近くに呼び込むことでTCRのキナーゼ経路を阻害し、CTLA4はCD28を物理的に妨害します。サイトカインのシグナルはSOCS1と呼ばれる分子がJAKに結合して抑制します。これらのブレーキ分子はエンジンがかかった後、少し時間が経ってエンジンを止めるために誘導されます。このような、アクセルの作用で誘導されてブレーキをかける制御のことをネガティブフィードバック調節と言います。これらブレーキ分子のことをがん免疫では『免疫チェックポイント分子』と呼んでいます。ただし、ブレーキ分子の発現誘導にも時間差があり、実はPD-1もCTLA4もT細胞の活性化の途中で早期に誘導されます。つまりアクセルと同時にブレーキをかけながら少し減速している状態です。さらに時間が経つとこれら以外のブレーキ(例えばTim3, Lag3, CD39など)がたくさん出てきます。これで完全に停止した状態になり、この状態が「疲弊(exhaustion)」と呼ばれる状態です。 そしてこれらのブレーキ分子の発現を誘導する転写因子がNR4aなのです。したがってNR4aは疲弊化を誘導する遺伝子とも言えます。
NR4aは核内に存在する転写因子(DNAに結合して転写(mRNA合成)を制御するタンパク質)で、核内受容体の一種です。核内受容体というのは通常はステロイドホルモン受容体のように、何らかの生理活性物質(リガンド)が結合することによってDNAに結合して転写を制御するタンパク質ですが、NR4aは何ら外から物質を加えなくても発現するだけで核に以降し転写を制御できます。NR4aにはNR4a1, NR4a2, NR4a3と3つが知られているのですが、機能的には皆同じと考えられています。
NR4aによる腫瘍免疫の制御
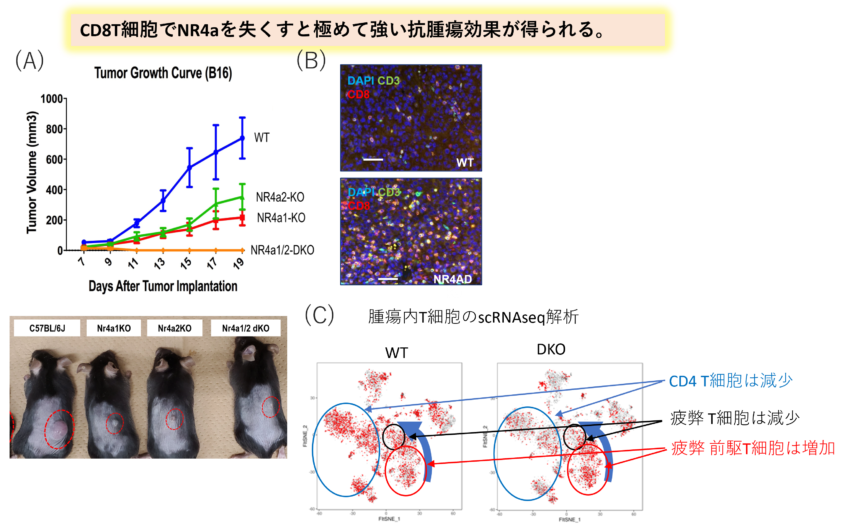
CD8T細胞特異的NR4a1およびNR4a2欠損マウスの抗腫瘍効果。CD8Creを発現するマウスを用いてCD8T細胞特異的にNR4a1とNR4a2を無くしたマウスを作成し、B16腫瘍細胞(メラノーマ)を移植した。(A)腫瘍細胞の成長とマウスの外観。NR4a1、NR4a2単独でも効果はあるが、両方無くすことで非常に強力な抗腫瘍活性が見られた。(B) 腫瘍内に浸潤したT細胞。NR4a1/2欠損CD8T細胞は野生型に比べると腫瘍内で活発に増えていることがわかる 。(C)腫瘍内T細胞のscRNAseq解析。NR4a1/2欠損T細胞ではCD4T細胞と疲弊化T細胞が減少し、逆に疲弊前駆T細胞と呼ばれる腫瘍を攻撃する能力の高いエフェクター(図1の中央の細胞に相当する)が増加している(Cell Rep . 2024; 43(3):113898 )。
免疫老化の制御機構の解明
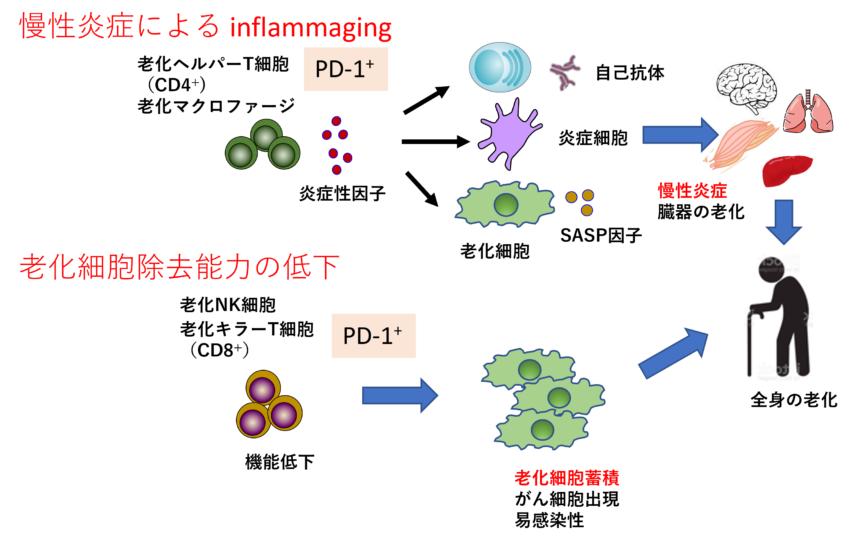
免疫老化が個体老化に及ぼす影響。免疫は通常は感染、がん細胞だけでなく老化細胞も早期に感知して処分していると考えられます。加齢による免疫機能の低下はこれらの殺機能を弱め、さまざまな臓器に老化細胞が蓄積し、寿命が短くなると考えられます(図3下)。さらに老化によってCD4T細胞やマクロファージは変質し炎症性サイトカイン(SASP因子)を放出し始めると考えられています。SASP因子は臓器に慢性的炎症を引き起こし成人病の原因となったり臓器の老化を引き起こします。このように免老化は2つの側面から個体の老化に関与すると考えられています。興味深いことに老化T細胞はやはりPD-1陽性でNR4aを高発現しています。私たちはNR4aは免疫老化でも重要な役割を果たしていると考え研究をすすめています。
脳関連疾患における免疫の意義の解明と治療応用
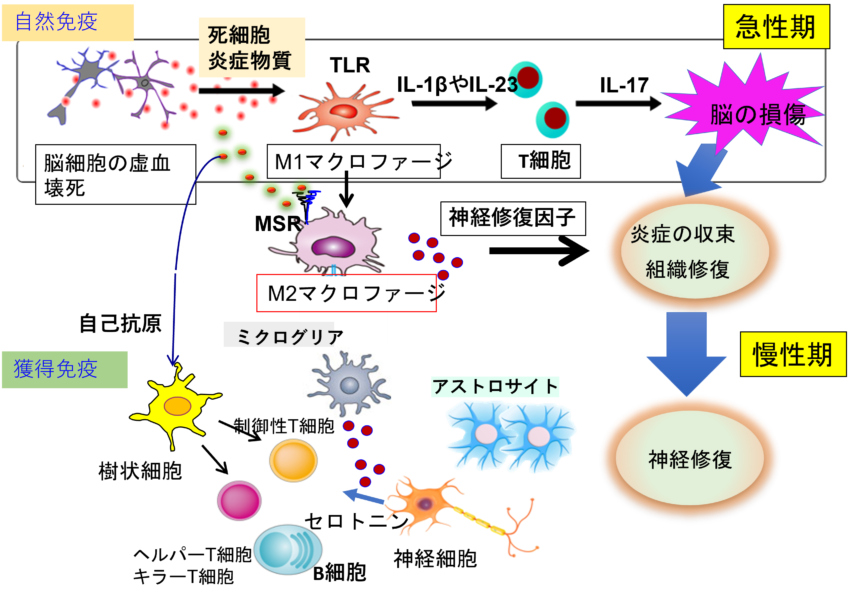
脳梗塞後の免疫応答 脳、神経と免疫。一見全く関係がないと思われがちな2つの生体システムですが、実は深いつつながりがあることがわかってきました。私たちは脳梗塞をモデルに免疫応答を研究してきました。脳梗塞発症1日目の急性期には浸潤マクロファージが死細胞由来のDAMPs (danger associate molecular patterns)の刺激を受けてIL-23やIL-1βなどの炎症性サイトカインを放出し、炎症と梗塞(細胞死)が拡大します。次に、遅れて浸潤するγδT細胞によって放出されるIL-17がさらに神経症状を悪化させます。炎症は組織損傷だけでなく組織の修復にも寄与します。梗塞4日目以降になると、脳内に浸潤したマクロファージはDAMPsを処理するスカベンジャー受容体MSR1や神経修復因子IGF1を発現する修復性マクロファージに転換します。さらに興味深いことに脳梗塞発症2週間後の慢性期には制御性T細胞(Treg)が大量に脳内に浸潤し、セロトニン受容体を発現するなど脳に適応した性質を獲得し、修復因子Amphiregulinを分泌しアストログリオーシスを制御して神経修復に寄与します。脳内に制御性T細胞が集積し神経保護に働くことは全く新しい概念であり大いに注目を集めました。これらの一連の研究は脳梗塞というこれまで単純な脳の組織損傷と考えられてきた現象に、様々な自然免疫、獲得免疫および組織修復因子が関与することを明らかにした点でパイオニア的な研究です。その後、脳梗塞のみならず、アルツハイマー病やALSなど神経変性疾患、自閉症などの精神疾患でもIL-17の関与が報告され、サイトカインと脳機能の分野で広く関心を集めています。私たちは現在脳内T細胞に焦点を当てて、脳と免疫について研究を行っています。

著書
免疫「超」入門
免疫学の楽しさと奥深さを体感できます。
講談社ブルーバックス
https://bookclub.kodansha.co.jp/productitem=0000384152
代表的な業績
- 1.Srirat T, Hayakawa T, Mise-Omata S, Nakagawara K, Ando M, Shichino S, Ito M, Yoshimura A NR4a1/2 deletion promotes accumulation of TCF1+ stem-like precursors of exhausted CD8+ T cells in the tumor microenvironment. Cell Rep. 2024 Mar 26;43(3):113898.
- 2.Ito M, Komai K, Omata-Mise S, Iizuka-Koga M, Noguchi Y, Kondo T, Sakai R, Matsuo K, Nakayama T, Yoshie O, Nakatsukasa H, Chikuma S, Shichita T and Yoshimura A. Brain regulatory T cells suppress astrogliosis and potentiate neurological recovery. Nature 2019 565(7738): 246-250
- 3.Wang TW, Johmura Y, Suzuki N, Omori S, Migita T, Yamaguchi K, Hatakeyama S, Yamazaki S, Shimizu E, Imoto S, Furukawa Y, Yoshimura A, Nakanishi M: Blocking PD-L1-PD-1 improves senescence surveillance and ageing phenotypes. Nature 2022, 611:358-64. DOI: 10.1038/s41586-022-05388-4
- 4.Chen J, López-Moyado IF, Seo H, Lio CJ, Hempleman LJ, Sekiya T, Yoshimura A, Scott-Browne JP, Rao A. NR4A transcription factors limit CAR T cell function in solid tumours. Nature, 2019 567(7749): 530-534
- 5.Hibino S, Chikuma S, Kondo T, Ito M, Nakatsukasa H, Omata-Mise S, Yoshimura A. Inhibition of Nr4a Receptors Enhances Antitumor Immunity by Breaking Treg-Mediated Immune Tolerance. Cancer Res. 2018; 78(11): 3027-3040.
- 6.Shichita T, Ito M, Morita R, Komai K, Noguchi Y, Ooboshi H, Koshida R, Takahashi S, Kodama T, Yoshimura A MAFB prevents excess inflammation after ischemic stroke by accelerating clearance of damage signals through MSR1. Nature Med 2017; 23: 723-732
- 7.Sekiya T, Kondo T, Shichita T, Morita R, Ichinose H, Yoshimura A. Suppression of Th2 and Tfh immune reactions by Nr4a receptors in mature T reg cells. J Exp Med. 2015; 212(10):1623-40.
- 8.Ito M, Shichita T, Okada M, Komine R, Noguchi Y, Yoshimura A, Morita R. 2015 Bruton’s tyrosine kinase is essential for NLRP3 inflammasome activation and contributes to ischaemic brain injury. Nature Commun. 2015; 6:7360. doi: 10.1038/ncomms8360.
- 9.Sekiya T, Kashiwagi I, Yoshida R, Fukaya T, Morita R, Kimura A, Ichinose H, Metzger D, Chambon P, Yoshimura A. Nr4a receptors are essential for thymic regulatory T cell development and immune homeostasis. Nature Immunol 2013; 14: 230-237.
- 10.Shichita T, Hasegawa E, Kimura A, Morita R, Sakaguchi R, Takada I, Sekiya T, Ooboshi H, Kitazono T, Yanagawa T, Ishii T, Takahashi H, Mori S, Nishibori M, Kuroda K, Akira S, Miyake K, Yoshimura A. Peroxiredoxin family proteins are key initiators of post-ischemic inflammation in the brain. Nature Med 2012; 18: 911-917.
- 11.Lu LF, Boldin MP, Chaudhry A, Lin LL, Taganov KD, Hanada T, Yoshimura A, Baltimore D, Rudensky A. Function of miR-146a in controlling Treg cell-mediated regulation of Th1 responses. Cell 2010; 142: 914-929.
- 12.Shichita T, Sugiyama Y, Ooboshi H, Sugimori H, Nakagawa R, Takada I, Iwaki T, Okada Y, Iida M, Cua DJ, Iwakura Y, Yoshimura A. Pivotal role of cerebral interleukin-17-producing γδT cells in the delayed phase of ischemic brain injury. Nature Med 2009; 15: 946-950.
- 13.Wakioka T, Sasaki A, Kato R, Shouda T, Matsumoto A, Miyoshi K, Tsuneoka M, Komiya S, Baron R, Yoshimura A. Spred is a Sprouty-related suppressor of Ras signalling. Nature 2001; 412(6847): 647-51. DOI: 10.1038/35088082.
- 14.Endo TA, Masuhara M, Yokouchi M, Suzuki R, Sakamoto H, Mitsui K, Matsumoto A, Tanimura S, Ohtsubo M, Misawa H, Miyazaki T, Leonor N, Taniguchi T, Fujita T, Kanakura Y, Komiya S, Yoshimura A. A new protein containing an SH2 domain that inhibits JAK kinases. Nature 1997 Jun 26; 387(6636): 921-4. DOI: 10.1038/43213.
- 15.Yoshimura A, Longmore G, Lodish HF. Point mutation in the exoplasmic domain of the erythropoietin receptor resulting in hormone-independent activation and tumorigenicity. Nature 1990 Dec 13; 348(6302): 647-9. DOI: 10.1038/348647a0. PMID: 2174515

